摘要
临床特征.
多巴胺β-羟化酶 (DBH) 缺乏症以交感去甲肾上腺素能功能缺乏伴正常的副交感和交感胆碱能功能为特征。患者显示出明显的心血管系统自主神经调节功能缺陷,易出现体位性低血压。虽然DBH缺乏症从出生开始就能表现出来,但是一般要到童年晚期才能得到诊断。婴儿和儿童期的眼睑下垂合并低血压,提示患有此病。在围产期,DBH缺乏症因呕吐、脱水、低血压、低体温和低血糖而加重,需要反复住院治疗;儿童运动能力下降。到成年早期,患者有显著的体位性低血压、运动耐力大幅下降、眼睑下垂和鼻塞。晕厥前症状包括眩晕、视力模糊、呼吸困难、颈部不适和胸痛。预期寿命未知,但是一些受累的个体已经活过了60年。
诊断/检测.
DBH缺乏症的诊断基于临床表现(包括心血管调节功能不良、其他自主神经功能障碍和正常出汗)、自主神经功能的生理学表现(显示交感去甲肾上腺素和肾上腺髓质功能异常但是迷走神经和交感胆碱能功能正常)和独特的生化特征(血浆去甲肾上腺素和肾上腺素很少或缺乏,血浆多巴胺水平5-10倍升高,这一发现可能是DBH缺乏症的特定表现)。DBH缺乏症是由DBH双等位基因的致病性变异引起的。
处理.
对症治疗:给予 L-反式-3,4-二羟苯基丝氨酸(屈昔多巴)缓解体位性低血压和其他症状。患者的反应没有针对自主神经功能障碍的标准治疗方法那么好。手术可以矫正上睑下垂。
原发表现的预防:屈昔多巴能够改善体位性低血压和其他症状,但是治疗停止就会复发。
监测:每两年评估一次肾功能(测量血浆肌酐和BUN浓度),如果肾功能损害很明显,可以更频繁地评估。也应该评估血浆镁和钾水平。
避免的药物/环境:未经治疗的患者应该避免高温环境、剧烈运动、久站不动和脱水。
妊娠处理:妊娠和分娩期间常规监测血压,如果需要的话应用调整剂量的屈昔多巴;分娩期间可能需要加大屈昔多巴的剂量,产后可能需要调整剂量。
遗传咨询.
DBH缺乏症以常染色体隐性遗传方式进行遗传。在怀孕的时候,受累个体的每个同胞有25%的机会是患者,50%的机会是无症状携带者,25%的机会不是患者也不是携带者。如果在一个家系中两个致病性变异都已明确,对于有风险的亲属进行携带者筛查是合理的。如果致病性变异在家系中的一个患者中被确定,通过实验室提供感兴趣的基因的产前检测或定制化检测项目对有风险的妊娠进行产前检测是合理的。
诊断
提示性的发现
患者通常在青春期第一次就诊,诉长期头晕和不能忍受站立或运动。患者和他们的父母会讲述一些行为,例如下蹲,用其来代偿站立的问题。因此,有以下临床、生理和实验室表现的个体应该怀疑多巴胺β-羟化酶(DBH)缺乏症[Vincent & Robertson 2002, Timmers et al 2004]:
临床表现
- 从仰卧位、坐位和站立位体征可以发现心血管系统调节功能明显下降:
- 仰卧位血压下降-正常,仰卧位心率下降或正常
- 直立位时收缩期血压<80mmHg
- 站立时心率代偿性的升高不足
- 不能站立不动超过一分钟
- 从眼科检查可以发现明显的自主神经功能障碍:
- 一些患者有上睑下垂
- 站立位时眼内压明显下降[Phillips et al 2013]
- 对光反射和调节反射瞳孔有一定程度的缩小,但是对羟化苯丙胺没有这种反应。副交感神经抑制剂能适当扩大瞳孔。
- 通常详细的病史和体格检查(包括神经系统检查)显示:
- 正常出汗
- 在一些受累的个体骨骼和肌肉系统的发现:
- 拱状腭
- 关节可过度伸展
- 深腱反射迟钝
- 轻度面部肌肉无力
- 骨骼肌肌张力减退
生理学检测的发现
自主神经功能的生理学检测,当能使用的时候,能够提供有很大特异性的诊断信息。自主神经功能测试结果(表 1)提示完全的DBH缺乏症包括交感去甲肾上腺素功能障碍和肾上腺髓质功能不全但是有正常的迷走神经和交感胆碱能功能[Biaggioni & Robertson 1987, van den Meiracker et al 1996]。
- Valsalva动作导致血压明显下降伴随心率加快,反应了副交感神经的撤离。超过IV期的过度的Valsalva动作不发生。
- 过度通气导致血压下降。
- 冷加压试验导致血压不是下降就是没有改变。
- 等长运动不能使血压明显升高。
注意:自主神经功能的进一步生理学检测结果点击这里。
表 1.
多巴胺β羟化酶缺乏症(DBHD)患者的自主神经功能检测结果
| DBHD 1 | 对照 1 | 数量: DBHD/对照 | P值 | ||
|---|---|---|---|---|---|
| 年龄(岁) | 26±14 | 34±10 | 0.033 | ||
| 窦性心律失常比率 | 1.3±0.21 | 1.4±0.21 | 8/86 | 0.266 | |
| ValsalvaII期 | δ SBP (mm Hg) | -41±25 | -7±22 | 7/55 | <0.001 |
| δ HR (bpm) | 29±11 | 30±16 | 7/53 | 0.828 | |
| ValsalvaIV期 | δ SBP (mm Hg) | -22±18 | 23±16 | 8/84 | <0.001 |
| δ HR (bpm) | 5±9 | -8±11 | 8/82 | 0.001 | |
| Valsalva比率 | 1.3±0.20 | 1.7±0.39 | 8/79 | <0.001 | |
| 过度通气 | δ SBP (mm Hg) | -14±12 | -7±12 | 9/86 | 454 |
| δ HR (bpm) | 14±19 | 11±11 | 8/86 | 0.308 | |
| 冷加压 | δ SBP (mm Hg) | 4±10 | 21±14 | 8/83 | 0.001 |
| δ HR (bpm) | 16±11 | 10±11 | 7/83 | 0.183 | |
| 握力 | δ SBP (mm Hg) | 2±6 | 17±13 | 7/83 | 0.003 |
| δ HR (bpm) | 15±11 | 10±10 | 7/83 | 0.230 | |
实验室发现
血浆儿茶酚胺. DBH缺乏症特有的生化特征:
- 血浆去甲肾上腺素(NE)和肾上腺素很少或缺乏,血浆多巴胺(DA)5-10倍升高。这样的组合可能能确定诊断DBH缺乏症。
- 血浆NE浓度应该低于检测下限 (<25 pg/mL或0.15 nmol/L)
- 血浆DA浓度通常高于100 pg/mL (0.65 nmol/L)。(一个非典型的患者直到73岁才被诊断,其血浆DA浓度为10,000 pg/mL (67 nmol/L)[Despas et al 2010])。
- 虽然压力感受器的传入和儿茶酚胺的释放机制都是正常的,DA的释放代替了NE。
注意:(1)使用对这些儿茶酚胺来说高度特异性的程序对NE和DA都进行分析很有必要。(2)使用一些反射性酶学方法检测儿茶酚胺,一部分的DA可能被错误地认为是肾上腺素[Robertson et al 1986]。血浆DA浓度能像正常人的NE那样对各种生理和药理刺激做出反应:
- 从仰卧位到直立位姿势的改变能使血浆DA浓度成倍或三倍增加。这一观察结果表明交感神经和反射弧是完整的,但是DA(而不是NE)在交感神经的突触中被储存和释放。
关于在DBH患者中能够见到的药理学发现点这里。
建立诊断
有以下表现的先证者能够建立DBH的诊断:
- 用高效液相色谱法和电化学检测发现血浆去甲肾上腺素和肾上腺素浓度很少或缺乏,血浆多巴胺浓度5-10倍升高。
也可以考虑包含DBH和其他感兴趣基因在内的表型靶向检测(见鉴别诊断)。多基因包内包含的基因和敏感性因不同的实验室以及随着时间的推移而不同。
表 2.
多巴胺β羟化酶缺乏症使用的分子遗传学检测
关于血浆DBH酶学分析的信息点击这里。
临床特征
临床描述
多巴胺β-羟化酶 (DBH)缺乏症以交感去甲肾上腺素能功能缺陷,副交感和交感胆碱能功能正常为特征。患者显示显著的心血管系统自主神经调节功能缺陷,但是中枢神经系统功能不全只有细微的征象[Robertson et al 1986, Man in ‘t Veld et al 1987, Timmers et al 2004, Jepma et al 2011]。虽然DBH缺乏症从出生开始就能表现出来,但是一般直到儿童晚期直立性低血压很严重的时候才得到诊断。因为报导的案例数有限,DBH缺乏症整个的临床谱还未知。在19个受累的个体(12个女性,7个男性)中报导的临床特征总结在表 3。在围生期,DBH缺乏症因呕吐、脱水、低血压、低体温和低血糖而加重,需要反复住院治疗。在大多数受累的婴儿,会出现睁眼延迟和上睑下垂。DBH缺乏症的儿童运动能力明显下降,可能是由于强体力活动引起的低血压。晕厥伴随体位性低血压通常认为是癫痫,促使试验性使用抗惊厥药物,虽然缺乏脑电图的异常。身心发育正常。症状一般在青春晚期恶化。到成年早期,受累的个体有显著的体位性低血压、运动耐力大幅度下降、上睑下垂和鼻塞。男性经历逆行射精或射精时间延长。DBH缺乏症的临床特征总结在
表 3。
表 3.
DBH缺乏症的临床特征
| 特征 | # 人数比例 1 |
|---|---|
| 严重的体位性低血压 | 19/19 (100%) |
| 贫血 | 8/14 (57%) |
| 上睑下垂 | 11/13 (85%) |
| 性成熟异常 | 0/12 |
| 关节可伸展性增大或可动性增加 | 6/10 (60%) |
| ECG异常 2 | 2/12 (17%) |
| 癫痫样症状 | 4/12 (33%) |
| 鼻塞 | 10/10 (100%) |
| 低血糖 | 3/11 (27%) |
| 深腱反射迟钝 | 3/9 (33%) |
| 血浆肌酐升高 | 5/10 (50%) |
| 多尿/遗尿 | 3/9 (33%) |
| 高腭 | 9/10 (90%) |
| BUN升高 | 6/9 (67%) |
| 肌张力低下 | 3/9 (.33%) |
| 餐后低血压 | 3/7 (43%) |
| 睡眠不规律 | 5/7 (71%) |
| 射精障碍 | 4/4 (100%) |
出现表现的个体的数目/评价表现的总个体数目
2.
ECG = 心电图
晕厥前的症状包括头晕、视力模糊、呼吸困难、颈部不适和偶尔出现的胸痛。在高温环境中或饱食后或饮酒后症状可能恶化。偶尔会发生不明原因的腹泻。在美国6个受累的个体被发现存在血尿素氮升高
[Garland et al 2005a, Garland et al 2009]。这可能是肾功能受损的证据。一个57岁的女性患者其估算的GFR降到了18 mL/min/1.73 m2。虽然缺乏去甲肾上腺素,DBH缺乏症的患者很显然地有相对正常的精神状态。5个受累的个体和10个配对的健康未受累参与者除了进行脑MRI、瞳孔测量和EEG等检查外,还进行了一系列详细的神经认知方面的测试。在大多数方面,不管是否进行屈昔多巴治疗,受累的个体的表现都与未受累的个体相似,提示在受累的个体中其他系统代偿了去甲肾上腺素的缺乏。脑MRI研究显示与未受累的个体相比,受累的个体脑的总体积减小,虽然两组的灰白质的相对比例和脑脊液是相似的。此外,当不进行治疗的时候,受累的个体有一个短暂的注意缺陷。在进行注意力集中测试的时候,参与者被要求识别用不同数量的字母隔开的2个数字。注意瞬脱指的是在识别第一个数字的200-400 msec内出现第二个数字时处理的缺陷。未治疗的患者精确地识别第二个数字的能力缺陷,但是用屈昔多巴治疗后表现改善[Jepma et al 2011]。房颤在一个个体中出现。另一个个体T波振幅下降,这可能反应了电解质的异常
[Man in ‘t Veld et al 1987]。DBH缺乏症的个体嗅觉功能相对地未受累,有完整的去甲肾上腺素神经元,与单纯性自主神经衰竭个体的显著缺陷以及周围神经退化不同
[Garland et al 2011]。一个2010年的病例报告描述了一个DBH缺乏症的个体(除了拥有这个疾病特征性的表现外)也有双侧眼组织缺损、短手和高弓足。调查者发现了染色体11p13上包含PAX6的一个嵌合缺失
[Erez et al 2010]。因为被诊断为DBH缺乏症的人非常少,那些不常见的表现与DBH缺失或多巴胺升高水平的关系还未知;他们可能是偶然的发现。然而,观察者[Man in ‘t Veld et al 1987]推测低血糖可能来自肾上腺髓质功能的衰竭和T波异常来自去甲肾上腺素控制功能的衰竭。与报导的围产期的低血糖相比,一个15岁的女孩用高血糖钳夹技术测试显示空腹血糖水平正常但是存在胰岛素抵抗
[Shibao et al 2014]。因为多巴胺既抑制催乳素的合成也抑制其分泌,在这些个体中出现一定程度的低催乳素血症是不足为奇的。四例DBH缺乏症患者已经死亡。三个在28、57和63岁时死于自然原因。一个在20岁时死亡,可能是由于自杀。那个28岁的男性尸检报告显示“脑神经元散在固缩、皮质胶质细胞孤立地小灶性地增生、心脏小动脉平滑肌增厚、心脏传导系统散在纤维化和肾小球硬化”[Cheshire et al 2006]。此外,延髓腹外侧区的神经元DBH免疫组化染色缺失。
发病率
DBH缺乏症的发病率未知。文献中报导的只有在所有西欧血统中的21个受累的个体,这表明它是一种罕见的疾病。
遗传相关(等位基因)疾病
除了在GeneReview中讨论过的那些表型,还未发现与DBH致病性变异相关的其他表型。
鉴别诊断
显著的儿茶酚胺异常能够把DBH缺乏症与其他疾病区分开来。其他的儿茶酚胺类疾病,例如芳香族L-氨基酸脱羧酶缺乏症(OMIM 608643),其临床表现不同于DBH缺乏症[Swoboda et al 2003]。
单纯性自主神经衰竭/自主神经病变. 单纯性自主神经衰竭或Bradbury-Eggleston综合征是一种自主神经系统退行性疾病,在生命的中期或晚期发病。也像DBH缺乏症一样,它以严重的体位性低血压为特征。不同于DBH缺乏症的是,它既影响交感神经系统,也影响副交感神经系统。少汗是常见的表现。单纯性自主神经衰竭的患者对所有的升压和降压刺激高度敏感。血浆和尿液中去甲肾上腺素(NE)浓度显著降低,有时能到正常的10%;血浆多巴胺(DA)浓度正常或降低,而不是像DBH缺乏症那样的升高。
系统性疾病. 一些自主神经功能障碍具有继发于系统性疾病的典型的自主神经病变的特征,例如糖尿病。
家族性自主神经功能障碍(FD) 影响感觉、交感和副交感神经元的发育和存活。它是一种从出生开始就表现出来的使人衰弱的疾病。在整个生命过程中神经元进行性持续性变性。受累的个体有胃肠道功能障碍、呕吐危机、反复肺炎、对疼痛和温度的敏感性改变和心血管系统不稳定。大约40%的个体有自主神经危机。已经注意到肾功能有年龄相关性的下降[Elkayam et al 2006]。临床上,DBH缺乏症区别于FD的是流泪正常、角膜反射和深腱反射完整、感觉功能正常、味觉和嗅觉功能正常和缺乏异常的胆碱能敏感性和皮内注射组胺反应。FD几乎只在德系犹太人中发现,而DBH缺乏症患者至今还没有发现德系犹太人的后代。家族性自主神经功能障碍的患者有HVA的高排泄率和NE代谢产物3-甲氧基-4-羟基扁桃酸(VMA)的低排泄率。血浆二羟苯基乙二酵(DHPG)浓度低;血浆DOPA(3,4-二羟基苯丙氨酸多巴)和DA浓度升高[Goldstein et al 2008]。遗传方式为常染色体隐性遗传。FD的诊断建立在ELP1 (IKBKAP)的分子遗传学检测上。在德系犹太人 的后代中两个致病性变异超过了99%的致病性等位基因。
ATP7A-相关性铜转运障碍. Menkes病、枕角综合征(OHS)和ATP7A-相关性远端运动神经病(DMN)是铜转运障碍性疾病,由铜转运ATP酶基因ATP7A的致病性变异引起。DBH是一种铜依赖性酶,因此在受累的个体中DBH活性下降,导致血浆和脑脊液中DOPA、DOPAC和DA浓度升高,DHPG浓度降低和几乎正常的NE浓度。严重的体位性低血压已经被报导[Christodoulou et al 1998]。然而,通过临床表现,Menkes病和枕角综合征的患者能与DBH缺乏症区分开来。典型的Menkes病的婴儿缺乏里程碑发育、肌张力低下、癫痫发作、2-3个月时生长停滞和头发的特征性改变(短、稀疏、粗糙、卷曲、通常颜色浅)。通常在3岁时死亡。枕角综合征以“枕角”为特征,斜方肌和胸锁乳突肌附着在枕骨的部位独特的楔状钙化。受累的个体还有皮肤和关节松弛、膀胱憩室、腹股沟疝和血管迂曲。智力正常或轻度减退。血清铜浓度和血清铜蓝蛋白浓度低。遗传方式为X-连锁。ATP7A的分子遗传学检测能够在超过95%的受累的个体中检测到致病性变异。
甲状腺素运载蛋白家族性淀粉样变性 其特征为慢性进行性周围感觉运动神经病变和自主神经病变以及一些非神经病性改变,如肾病、心肌病、玻璃体混浊和中枢神经系统淀粉样变性。此病经常在三四十岁起病;症状的出现可能更晚。甲状腺素运载蛋白淀粉样多神经病的基本特征为慢性进行性感觉运动和自主神经病变。自主神经病变可能是此病出现的第一个临床症状;症状包括体位性低血压、便秘腹泻交替出现、恶心呕吐发作、胃排空延迟、阳痿、无汗症和尿潴留或尿失禁。遗传方式为常染色体显性遗传。TTR的分子遗传学检测能够检测到超过99%的(淀粉样蛋白的)致病性变异。
多系统萎缩 (MSA,Shy-Drager综合征,SDS)(OMIM 146500)。像DBH缺乏症一样,体征包括体位性低血压,但是也出现锥体外系或小脑异常的表现。MSA在30岁后起病。
处理
对症治疗
大体上,DBH缺乏症的治疗是支持性的和在于缓解体位性症状。治疗选择为给予L-反式-3,4-二羟苯基丝氨酸(或屈昔多巴,在美国商品名为Northera™)。屈昔多巴通过L-芳香族氨基酸脱羧酶直接转换成NE,因此绕过了DBH(图 1)。
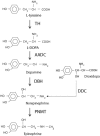
图 1.
来自多巴胺或屈昔多巴的去甲肾上腺素的合成
- 每日给予100-500mg屈昔多巴2或3次口服能够升高血压,也能使血浆NE浓度恢复到正常范围;然而,尿液NE的排泄超过了正常的水平。
- 虽然NE浓度变得能够检测到,血浆肾上腺素浓度依然处于检测水平以下。
- 给予屈昔多巴能够使DOPA恢复到正常范围内,能一定程度减少DA,但是血浆DA浓度和它的代谢产物仍然有一定程度的升高[Biaggioni & Robertson 1987]。
- 儿茶酚胺的这种有利改变缓解了体位性低血压和使功能恢复到近乎正常的水平。一个受累的女性每日给予1200mg的屈昔多巴,大约在诊断后的5年完成了马拉松[Garland et al 2005b]。
DBH缺乏症患者的自主神经衰竭症状能对标准治疗方法有一定程度的反应,但是没有对屈昔多巴反应那么好。
- 氟氢可的松,0.1-0.3 mg每天的剂量,有一定程度的益处,但是显著的体位性低血压仍能发生。
- 吲哚美辛(50 mg 3x/天)在升高血压方面效果有限。
- 甲基酪氨酸,一种酪氨酸羟化酶抑制剂,能够升高DBH缺乏症患者的血压和降低尿液DA浓度。然而,用于嗜铬细胞瘤中的正常浓度升压效应太强,有一定的副作用,包括镇静。
上睑下垂能被手术矫正。当需要的时候,需要对鼻窦问题进行治疗。
主要表现的预防
屈昔多巴能改善体位性低血压和一些症状,但是如果治疗停止的话还会复发。
继发性并发症的预防
屈昔多巴对肾功能的效应未知。
监测
至少每两年通过BUN和血浆肌酐评估一次肾功能,如果功能丧失很明显,应该更频繁。还应评估血浆镁和钾。应鼓励用屈昔多巴治疗的患者向其医生报告任何的不良事件。应该每年一次询问患者关于屈昔多巴对抗体位性低血压和其他症状的持续疗效。可能需要进行剂量的调整。
需避免的药物/环境
未经治疗的DBH缺乏症患者应该避免高温环境、剧烈运动、站立不动和脱水。
妊娠处理
至少2个受累的女性通过简单的生产过程已经成功地分娩了[Scurrah et al 2002]。基于这些经验,建议受累的妊娠女性在妊娠和分娩过程中规律地监测血压,这样就能根据需要调整屈昔多巴的剂量。在分娩的时候,根据需要,可能需要准备1个或2个额外的屈昔多巴剂量。在产后也需要进行剂量的调整。母亲应用屈昔多巴治疗对胎儿发育的影响在人类中还没有研究;然而,对妊娠动物进行的研究不提示能够增加后代致畸的风险。
还在调研阶段的治疗方法
对于各种疾病和情况临床研究的信息搜索ClinicalTrials.gov获得。注意:对于此病可能没有临床试验。
遗传咨询
遗传咨询是向患者及其家庭提供关于遗传性疾病的特征、遗传方式及影响的信息的过程,以帮助他们做出信息完备的医学和个人决策。以下部分涉及到遗传风险评估以及根据家族史和遗传检测确定家系成员的遗传状态。这一部分不是为了解决患者可能面临的所有个人的、文化的、伦理学的问题,也不能替代遗传学专业人员的咨询工作。—ED.
遗传方式
多巴胺β羟化酶缺乏症以常染色体隐性遗传方式进行遗传。
携带者检测
分子遗传学检测. 在对有风险的亲属进行携带者检测之前需要先在家系中确定DBH 的致病性变异。
生化遗传学检测. 在确定携带者状态时不推荐进行生化检测。有许多的不是DBH缺乏症的个体其血浆DBH活性极低。至少一些DBH缺乏症患者的父母有正常的自主神经功能和正常的儿茶酚胺水平。
遗传咨询的相关问题
生育规划
- 确定遗传风险、携带者状态的确定和产前检测可行性分析的最佳时间是妊娠前。
DNA银行 储存DNA(通常从白细胞中提取)以备将来使用。因为可能检测方法,我们对基因、等位基因变异和疾病的理解在将来都会改善,应该考虑对受累的个体进行DNA存储。
产前检测和植入前遗传学诊断
一旦DBH致病性变异在一个受累的家系成员中被确定,可考虑对风险增加的妊娠进行产前检测和DBH缺乏症的植入前遗传学诊断。对那些不影响智力和有一些可获得的治疗方法的情况(像DBH缺乏症)要求进行产前检测是不常见的。关于是否进行产前检测,医疗人员之间以及家系成员内部可能视角不同,特别是当检测的目的是为了决定是否终止妊娠而不是早期诊断。虽然大多数的中心对于产前检测的决定考虑的是父母的选择,对这些问题进行讨论也是合适的。
资源
为了帮助患有此病的个体及其家庭,GeneReviews工作人员选择了如下的疾病特异性和/或伞状支持组织和/或注册机构。对于其他组织提供的信息,GeneReviews不予负责。关于选择标准的信息,点击这里。
- Autonomic Disorders Consortium
- RDCRN Patient Contact Registry: Autonomic Disorders Consortium
分子遗传学
分子遗传学和OMIM表里的信息可能不同于GeneReview里其他部分的信息:表里可能包含最近的信息。-ED.
表 A.
多巴胺β羟化酶缺乏症:基因和数据库
基因结构.DBH 大约23kb,由12个外显子组成。对于基因和蛋白详细信息的总结,见表 A,基因.
良性变异.DBH的正常变异与既不是受累的的个体又不是携带者的DBH活性水平的变异相关。血浆DBH浓度十倍的差异在正常对照中也常被报导,DBH是活性水平变化的主要因素。血浆DBH浓度的遗传率估计为0.98。在人类群体中,寡基因遗传几乎占了所有的血浆DBH浓度的大的个体差异。与DBH活性水平相关的几个DBH 上的良性变异已经被确定。最令人信服的证据是基因5' UTR区的c.-979T>C变异(T是最小等位基因)与低DBH活性相关[Zabetian et al 2001]。DBH内含子9上的一个MspI多态性位点[Wei et al 1996]、5’ UTR (表 4)的一个19-bp 插入/缺失多态性(表 4)[Cubells et al 1998, Robinson et al 2001]、外显子 2 3’末端的一个变异(c.486A>G)[Cubells et al 1998]和5’UTR区的一个GT 微卫星重复g.136496870_136496871[11_15](表 4)[Porter et al 1992]也与DBH活性相关[Cubells et al 1998]。一些表面上不受影响的个体有持续性的非常低水平的DBH活性[Zabetian et al 2001]。在欧洲美国人中,c.-979位T等位基因的纯合子预示着非常低的DBH活性,然而杂合性显示DBH活性分布在中间水平,表明共显性遗传。值得注意的是,当血浆DBH浓度低的个体只有一小部分有DBH缺乏症的临床特征时,成千上万未受累的个体也有低的血浆DBH浓度。一些血浆DBH浓度检测不到的DBH缺乏症的荷兰患者和家系成员有一个致病性的DBH等位基因和c.-979T等位基因的纯合子,但是没有临床表型(例如几乎正常的血浆去甲肾上腺素和肾上腺素浓度,没有体位性症状)[Deinum et al 2004]。最近,c.-979C等位基因被发现与肾上腺素分泌增加和基础血压升高有关,也与血压的压力介导的刺激增强有关[Chen et al 2010]。这个变异和c.486A>G已经被确认为能影响mRNA的表达[Barrie et al 2014]。
致病性变异.DBH基因的变异与受累的个体DBH活性减弱有关第一次被Kim et al [2002]在两个DBH缺乏症患者中确定: c.[339+2T>C];[342C>A]的一个复合杂合子和c.339+2T>C和两个错义变异c.[301G>A;1033G>A]的一个等位基因的复合杂合子。这些变异在其他的自主神经疾病中未被报导[Cho et al 2003]。c.301G>A变异发生在跨物种的氨基酸变异区域,不像其他两个位于保守区的错义变异一样是强的候选变异[Kim et al 2002]。第三个复合杂合的患者最近被确定:c.[339+2T>C];[c.1085C>A] [Kim et al 2011]。在四个DBH缺乏症的荷兰家系中c.339+2T>C 致病性变异和另外三个致病性变异被确定[Deinum et al 2004]。受累的个体是c.339+2T>C的纯合子、c.806G>T的纯合子和c.[339+2T>C];[617delA]、c.[339+2T>C];[1667A>G]的复合杂合子。
表 4.
选择的DBH变异
| 变异分类 | DNA核苷酸改变 (别名 1) | 位置 | 预测的蛋白改变 (别名 1) | 参考序列 |
|---|---|---|---|---|
| 良性 | (19-bp 插入/缺失) 2 | 离转录起始位点4.7kb的5’端 | -- | GRCh37-/hg19 |
| g.136496870_136496871 (11_15) 3 | 5’UTR | -- | ||
| c.486A>G (444 g/a) | 外显子2剪接供体位点 | p.Glu162Glu | NM_000787-.3 NP_000778-.3 | |
| c.-979T>C 4 | 5' UTR | -- | ||
| (MspI 多态性) 4 | 内含子9 | |||
| 致病性 | c.301G>A (G259A) | 外显子1 | p.Val101Met (V87M) | |
| c.339+2T>C 5 (IVS1+2T>C) | 内含子1 | -- | ||
| c.342C>A (C300A) | 外显子2 | p.Asp114Glu (D100E) | ||
| c.617delA (c.575delA) | 外显子3 | p.Glu206GlyfsTer82 | ||
| c.806G>T (G764T) | 外显子4 | p.Cys269Phe (C255F) | ||
| c.1033G>A (G991A) | 外显子6 | p.Asp345Asn (D331N) | ||
| c.1085C>A (C1043A) | 外显子6 | p.Ala362Glu (A348E) | ||
| c.1667A>G (A1625G) | 外显子11 | p.Tyr556Cys (Y542C) |
变异分类需注意:表格中列出的变异由作者提供。GeneReviews工作人员没有再单独去核实变异的分类。
命名需注意:GeneReviews按照人类基因组变异协会(varnomen-.hgvs.org)的标准命名规定来命名。对于命名的解释见快速参考。
1.
不符合当前命名规定的变异名称
2.
3.
在人群中介于11到15个重复之间的GT双核苷酸重复序列[Porter et al 1992]
4.
与DBH活性水平相关的良性变异(见正常 基因产物)
5.
在欧洲裔美国人和非洲裔美国人c.339+2T>C被报导的等位基因频率为0.001,没有自主神经功能障碍[Zabetian et al 2003]。
正常 基因产物. 多巴胺β羟化酶(3,4-二羟苯基乙胺,抗坏血酸:双氧氧化还原酶;DBH)是位于中枢和外周去甲肾上腺素能神经元和肾上腺髓质的一种需铜二聚体或四聚体酶。DBH以膜结合型(神经元囊泡)和可溶性(泡内)形式存在,分别依赖于信号肽的存在或缺失。四聚体糖蛋白分子量大约为290,000道尔顿。四个亚单位被二硫桥连接为两个二聚体,然后彼此用非共价键连接起来。每一摩尔的DBH有2到7个摩尔的铜,铜对于酶的活性是必需的。对于酶的活性来说,DBH也需要分子氧和抗坏血酸或一些其他电子源。连锁分析和相关分析发现DBH位点是体液中控制DBH水平的主要基因
异常 基因产物. c.339+2T>C变异导致终止密码子提前出现,形成一个异常的剪接产物,导致DBH蛋白检测不到。外显子2和6上的致病性变异阻止了正常蛋白质的转运[Kim et al 2011]。
参考资料
引用文献
- Barrie ES, Weinshenker D, Verma A, Pendergrass SA, Lange LA, Ritchie MD, Wilson JG, Kuivaniemi H, Tromp G, Carey DJ, Gerhard GS, Brilliant MH, Hebbring SJ, Cubells JF, Pinsonneault JK, Norman GJ, Sadee W. Regulatory polymorphisms in human DBH affect peripheral gene expression and sympathetic activity. Circ Res. 2014;115:1017-25. [PMC free article: PMC4258174] [PubMed: 25326128]
- Biaggioni I, Robertson D. Endogenous restoration of noradrenaline by precursor therapy in dopamine-beta-hydroxylase deficiency. Lancet. 1987;2:1170-2. [PubMed: 2890806]
- Chen Y, Wen G, Rao F, Zhang K, Wang L, Rodriguez-Flores JL, Sanchez AP, Mahata M, Taupenot L, Sun P, Mahata SK, Tayo B, Schork NJ, Ziegler MG, Hamilton BA, O'Connor DT. Human dopamine beta-hydroxylase (DBH) regulatory polymorphism that influences enzymatic activity, autonomic function, and blood pressure. J Hypertens. 2010;28:76-86. [PMC free article: PMC2860271] [PubMed: 20009769]
- Cheshire WP Jr, Dickson DW, Nahm KF, Kaufmann HC, Benarroch EE. Dopamine beta-hydroxylase deficiency involves the central autonomic network. Acta Neuropathol. 2006;112:227-9. [PubMed: 16830134]
- Cho S, Kim CH, Cubells JF, Zabetian CP, Hwang DY, Kim JW, Cohen BM, Biaggioni I, Robertson D, Kim KS. Variations in the dopamine beta-hydroxylase gene are not associated with the autonomic disorders, pure autonomic failure, or multiple system atrophy. Am J Med Genet A. 2003;120A:234-6. [PubMed: 12833405]
- Christodoulou J, Danks DM, Sarkar B, Baerlocher KE, Casey R, Horn N, Tümer Z, Clarke JT. Early treatment of Menkes disease with parenteral copper-histidine: long-term follow-up of four treated patients. Am J Med Genet. 1998;76:154-64. [PubMed: 9511979]
- Cubells JF, Kranzler HR, McCance-Katz E, Anderson GM, Malison RT, Price LH, Gelernter J. A haplotype at the DBH locus, associated with low plasma dopamine beta-hydroxylase activity, also associates with cocaine-induced paranoia. Mol Psychiatry. 2000;5:56-63. [PubMed: 10673769]
- Cubells JF, van Kammen DP, Kelley ME, Anderson GM, O'Connor DT, Price LH, Malison R, Rao PA, Kobayashi K, Nagatsu T, Gelernter J. Dopamine beta-hydroxylase: two polymorphisms in linkage disequilibrium at the structural gene DBH associate with biochemical phenotypic variation. Hum Genet. 1998;102:533-40. [PubMed: 9654201]
- Deinum J, Steenbergen-Spanjers GC, Jansen M, Boomsma F, Lenders JW, van Ittersum FJ, Hück N, van den Heuvel LP, Wevers RA. DBH gene variants that cause low plasma dopamine beta hydroxylase with or without a severe orthostatic syndrome. J Med Genet. 2004;41:e38. [PMC free article: PMC1735728] [PubMed: 15060114]
- Despas F, Pathak A, Berry M, Cagnac R, Massabuau P, Liozon E, Galinier M, Senard JM. DBH deficiency in an elderly patient: efficacy and safety of chronic droxidopa. Clin Auton Res. 2010;20:205-7. [PubMed: 20063034]
- Elkayam L, Matalon A, Tseng CH, Axelrod F. Prevalence and severity of renal disease in familial dysautonomia. Am J Kidney Dis. 2006;48:780-6. [PubMed: 17059997]
- Erez A, Li J, Geraghty MT, Ben-Shachar S, Cooper ML, Mensing DE, Vonalt KD, Ou Z, Pursley AN, Chinault AC, Patel A, Cheung SW, Sahoo T. Mosaic deletion 11p13 in a child with dopamine beta-hydroxylase deficiency--case report and review of the literature. Am J Med Genet A. 2010;152A:732-6. [PubMed: 20186791]
- Garland EM, Gamboa A, Okamoto L, Raj SR, Black BK, Davis TL, Biaggioni I, Robertson D. Renal impairment of pure autonomic failure. Hypertension. 2009;54:1057-61. [PMC free article: PMC2796115] [PubMed: 19738158]
- Garland EM, Raj SR, Biaggioni I, Black BK, Robertson D. A hyperdopaminergic nephropathy in dopamine beta hydroxylase deficiency. Clin Auton Res. 2005a;15:321.
- Garland EM, Raj SR, Demartinis N, Robertson D. Case report: Marathon runner with severe autonomic failure. Lancet. 2005b;366 Suppl 1:S13. [PubMed: 16360730]
- Garland EM, Raj SR, Peltier AC, Robertson D, Biaggioni I. A cross-sectional study contrasting olfactory function in autonomic disorders. Neurology. 2011;76:456-60. [PMC free article: PMC3034411] [PubMed: 21282592]
- Goldstein DS, Holmes C, Axelrod FB. Plasma catechols in familial dysautonomia: a long-term follow-up study. Neurochem Res. 2008;33:1889-93. [PMC free article: PMC5241098] [PubMed: 18357519]
- Jepma M, Deinum J, Asplund CL, Rombouts SA, Tamsma JT, Tjeerdema N, Spapé MM, Garland EM, Robertson D, Lenders JW, Nieuwenhuis S. Neurocognitive function in dopamine-β-hydroxylase deficiency. Neuropsychopharmacology. 2011;36:1608-19. [PMC free article: PMC3138665] [PubMed: 21471955]
- Kim CH, Leung A, Huh YH, Yang E, Kim DJ, Leblanc P, Ryu H, Kim K, Kim DW, Garland EM, Raj SR, Biaggioni I, Robertson D, Kim KS. Norepinephrine deficiency is caused by combined abnormal mRNA processing and defective protein trafficking of dopamine beta-hydroxylase. J Biol Chem. 2011;286:9196-204. [PMC free article: PMC3059068] [PubMed: 21209083]
- Kim CH, Zabetian CP, Cubells JF, Cho S, Biaggioni I, Cohen BM, Robertson D, Kim KS. Mutations in the dopamine beta-hydroxylase gene are associated with human norepinephrine deficiency. Am J Med Genet. 2002;108:140-7. [PubMed: 11857564]
- Man in ‘t Veld AJ, Boomsma F, Moleman P, Schalekamp MA. Congenital dopamine-beta-hydroxylase deficiency. A novel orthostatic syndrome. Lancet. 1987;1:183-8. [PubMed: 2880016]
- Phillips L, Robertson D, Melson MR, Garland EM, Joos KM. Pediatric ptosis as a sign of treatable autonomic dysfunction. Am J Ophthalmol. 2013;156:370-374.e2. [PMC free article: PMC3720787] [PubMed: 23622564]
- Porter CJ, Nahmias J, Wolfe J, Craig IW. Dinucleotide repeat polymorphism at the human dopamine beta-hydroxylase (DBH) locus. Nucleic Acids Res. 1992;20:1429. [PMC free article: PMC312204] [PubMed: 1561108]
- Robertson D, Goldberg MR, Onrot J, Hollister AS, Wiley R, Thompson JG Jr, Robertson RM. Isolated failure of autonomic noradrenergic neurotransmission. Evidence for impaired beta-hydroxylation of dopamine. N Engl J Med. 1986;314:1494-7. [PubMed: 3010116]
- Robinson PD, Schutz CK, Macciardi F, White BN, Holden JJ. Genetically determined low maternal serum dopamine beta-hydroxylase levels and the etiology of autism spectrum disorders. Am J Med Genet. 2001;100:30-6. [PubMed: 11337745]
- Scurrah NJ, Ross AW, Solly M. Peripartum management of a patient with dopamine beta-hydroxylase deficiency, a rare congenital cause of dysautonomia. Anaesth Intensive Care. 2002;30:484-6. [PubMed: 12180590]
- Shibao C, Garland EM, Luther JM, Celedonio JE, Raj SR, Biaggioni I, Robertson D. Hyperinsulinemia and insulin resistance in dopamine beta-hydroxylase deficiency. Clin Auton Res. 2014;24:223A.
- Swoboda KJ, Saul JP, McKenna CE, Speller NB, Hyland K. Aromatic L-amino acid decarboxylase deficiency: overview of clinical features and outcomes. Ann Neurol. 2003;54 Suppl 6:S49-55. [PubMed: 12891654]
- Timmers HJ, Deinum J, Wevers RA, Lenders JW. Congenital dopamine-beta-hydroxylase deficiency in humans. Ann N Y Acad Sci. 2004;1018:520-3. [PubMed: 15240410]
- van den Meiracker AH, Boomsma F, Man in 't Veld AJ. Dopamine-b-hydroxylase deficiency. In: Robertson D, Low PA, Polinsky RJ, eds. Primer on the Autonomic Nervous System. San Diego: Academic Press Inc; 1996:205-8.
- Vincent S, Robertson D. The broader view: catecholamine abnormalities. Clin Auton Res. 2002;12 Suppl 1:I44-9. [PubMed: 12102462]
- Wei J, Ramchand CN, Hemmings GP. A study of the relationship between the DBH activity in serum and a MspI polymorphic site in intron 9 of the human DBH gene in schizophrenia. Schizophr Res. 1996;22:77-80. [PubMed: 8908693]
- Zabetian CP, Anderson GM, Buxbaum SG, Elston RC, Ichinose H, Nagatsu T, Kim KS, Kim CH, Malison RT, Gelernter J, Cubells JF. A quantitative-trait analysis of human plasma-dopamine beta-hydroxylase activity: evidence for a major functional polymorphism at the DBH locus. Am J Hum Genet. 2001;68:515-22. [PMC free article: PMC1235285] [PubMed: 11170900]
- Zabetian CP, Romero R, Robertson D, Sharma S, Padbury JF, Kuivaniemi H, Kim KS, Kim CH, Kohnke MD, Kranzler HR, Gelernter J, Cubells JF. A revised allele frequency estimate and haplotype analysis of the DBH deficiency mutation IVS1+2T --> C in African- and European-Americans. Am J Med Genet. 2003;123A:190-2. [PubMed: 14598346]
推荐阅读
- Corominas R, Ribases M, Camiña M, Cuenca-León E, Pardo J, Boronat S, Sobrido MJ, Cormand B, Macaya A. Two-stage case-control association study of dopamine-related genes and migraine. BMC Med Genet. 2009;10:95. [PMC free article: PMC2758864] [PubMed: 19772578]
- Fernandez F, Lea RA, Colson NJ, Bellis C, Quinlan S, Griffiths LR. Association between a 19 bp deletion polymorphism at the dopamine beta-hydroxylase (DBH) locus and migraine with aura. J Neurol Sci. 2006;251:118-23. [PubMed: 17095019]
- Robertson D, Biaggioni I, Burnstock G, Low PA, Paton JFR, eds. Primer on the Autonomic Nervous System. 3 ed. Oxford, UK: Academic Press; 2012.
- Senard JM, Rouet P. Dopamine beta-hydroxylase deficiency. Orphanet J Rare Dis. 2006;1:7. [PMC free article: PMC1459119] [PubMed: 16722595]
- Wei J, Ramchand CN, Hemmings GP. TaqI polymorphic sites at the human dopamine beta-hydroxylase gene possibly associated with biochemical alterations of the catecholamine pathway in schizophrenia. Psychiatr Genet. 1998;8:19-24. [PubMed: 9564683]
章注
修订历史
- 2015年10月29日 发布实时全面更新
- 2013年1月24日 发布实时全面更新
- 2010年9月16日 发布实时全面更新
- 2005年12月16日 在网页上发布实时全面更新
- 2003年9月4日 内容发布到实时网页上
- 2003年6月27日 原创投稿
