概述
临床特征
常染色体显性遗传家族性渗出性玻璃体视网膜病变(adFEVR)主要表现为周边视网膜无血管灌注区,由视网膜缺血导致的继发性并发症表型各异, 视网膜无灌注在新生儿期即可出现并出现后遗症,成年早期较稳定,病程进展。疾病表现度差异大,同家系中可从无症状到严重表型(比如从轻度表型到致盲)。
诊断/检测
adFEVR的诊断基于常染色体显性遗传家族史,眼底镜检查或眼底荧光素血管造影示双侧周围视网膜无血管关注区、 巩膜缩进。已知有三个致病基因:FZD4,编码frizzled-4蛋白;LRP5,编码low-density lipoprotein receptor-related protein 5蛋白和TSPAN12,编码tetraspanin-12蛋白。基因致病可以解释半数以下adFEVR病例,另有定位关联染色体区域,EVR3,但基因尚未被确认。
疾病管理.
对症治疗:预防性冷冻或氩激光光凝治疗,可诱导视网膜血管缺血引起的新生血管生长消退,治疗类似的视网膜孔和视网膜渗出区,以防止视网膜脱离;传统的手术方法可以修复因视网膜牵拉而产生的孔源性视网膜脱离,渗出性视网膜脱离可以通过冷冻治疗来稳定,但两者的预后均较保守谨慎。
预防继发性并发症:治疗骨质疏松症的药物可用以降低骨密度,但是,目前还没有长期的跟踪数据支持。
监测: 定期检查儿童眼底,评估是否有新生血管、牵拉或渗出物,定期临床评估视网膜牵拉。
亲属患病风险评估: 眼底检查和眼底荧光素血管造影可鉴别特征性病变,以便早期治疗
诊断
临床诊断
adFEVR诊断基于以下方面:
- 常染色体显性遗传家族史
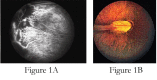
- 双侧视网膜周围无血管 (Figure 1)
- 视网膜无血管通常是短暂的,常需借助间接检眼镜和巩膜压痕法。
- 视网膜血管改变可通过眼底荧光素血管造影清晰辨认,一项研究表明该方法诊断率为100%[Ober et al 1980]。
其它视网膜异常可支持诊断:
- 视网膜新生血管与周围刷状缘吻合
- 外周维管束积聚
- 视网膜空洞、脱落、剥离
- 视网膜剥离导致的视网膜牵引 (伴有黄斑异位和/或后极血管矫直,或后极血管矫直,锐角血管分支)
- 视网膜剥离导致的渗出
- 镰状视网膜折叠
罕见的视网膜特征:
- 视网膜劈裂症
- 巨型视网膜裂孔
电生理无特异表现。
分子遗传学检测
基因 目前,已知3个基因与adFEVR有关:
- FZD4, 编码frizzled-4 [Robitaille et al 2002]
- LRP5, 编码low-density lipoprotein receptor-related protein 5 [Toomes et al 2004a]
- TSPAN12, 编码tetraspanin-12 [Poulter et al 2010, Nikopoulos et al 2010b]
基因致病占比在不同研究各异:
- FZD4. 在早期鉴定性研究中,FZD4基因致病占40% (2/5) [Robitaille et al 2002]。多数该基因的检测研究显示该基因致病占比在20%-40%,尽管部分研究检出率更低,主要研究有:
- 20% (5/24) [Kondo et al 2003]
- 20% (8/40) [Toomes et al 2004b]
- 7% (1/13) [MacDonald et al 2005]
- 3% (2/56) [Qin et al 2005]
- 3% (3/53) [Nallathambi et al 2006]
- 14% (9/63) [Drenser et al 2009]
- 40% (8/20) [Boonstra et al 2009]
- 31% (5/16) [Nikopoulos et al 2010a]
- 31% (15/48) [Jia et al 2010]
- 17% (12/68) [Robitaille et al 2011]
- LRP5. 在早期坚定性研究中,LRP5 突变占18% (6/32) [Toomes et al 2004a]。后续研究认为该基因致病占10%到25% (7/56, 2/20 and 4/16) [Qin et al 2005, Boonstra et al 2009, Nikopoulos et al 2010a]。
- TSPAN12. TSPAN12被两个研究团队所鉴定,[Poulter et al 2010]研究认为该基因致病占10%受累的患者,Nikopoulos等研究则认为突变率应为更高45% (5/11),该数据并未真实反映TSPAN12 基因突变率,由于家系中的建立者突变。后续一项研究认为突变率在3% (3/90) [Kondo et al 2011]。
其它基因异质性证据 adFEVR基因已有第4个定位研究,但基因尚未确定[Downey et al 2001]。
临床检测
- FZD4. FZD4基因序列分析已鉴定出不同突变类型(错义、无义、小的缺失、插入突变),然而暂未见剪接突变,也无热点突变区域。
- LRP5. LRP5基因序列分析鉴定出不同突变类型(错义、无义、小的缺失、插入突变、剪接),全基因区域都可见突变,无热点突变区域,家系间突变谱各异。
Table 1.
adFEVR分子遗传学检测概述
| 基因 1 | 基因突变占比 | 检测方法 | 突变检测 2 |
|---|---|---|---|
| FZD4 | 4%-40% | 序列分析 3 | 序列变异 |
| LRP5 | 12%-25% | ||
| TSPAN12 | 3%-10% |
- 1.
染色体 位点和蛋白信息参见 Table A. Genes and Databases
- 2.
等位基因信息参见Molecular Genetics
- 3.
检测策略
先证者诊断的建立与确认
- adFEVR诊断基于常染色体显性遗传家族史、双侧视网膜无血管、间接眼检镜巩膜压痕检查或眼底荧光素造影检查。
- FZD4基因序列分析
- 若未检出突变,检测LRP5基因。
- 若仍未检出,检测TSPAN12基因。
- 考虑并非所有致病基因已被鉴定出,上述3个基因未检出突变时仍不能排除基因致病。
产前诊断或植入前遗传诊断 (PGD)对于患病家系成员妊娠是可选的方案。
临床特征
临床描述
几乎所有adFEVR患者可有外周视网膜无血管灌注,一般无临床症状,视网膜缺血可导致继发性并发症,视网膜无血管灌注被认为可在出生后即出现,并在成年后期出现后遗症,后续研究也支持该疾病为终身进展性[Ober et al 1980, Tasman et al 1981][Shukla et al 2003]。
adFEVR有可变的表现度,甚至毫无临床症状,表型谱较广,即便在同个患病家系中,可从无症状到严重的眼疾,可致盲。
Shukla et al [2003]报道41%轻度表型的患者视力正常、唯一的表现是无症状的外周视网膜无血管灌注,一部分表现为视网膜渗出和视视网膜牵引,20%发展为孔源性视网膜脱离,严重表型患者表现为十岁内视力下降、斜视或白曈症[Miyakubo et al 1984, van Nouhuys 1991]。
adFEVR携带LRP5 突变患者被报道伴有骨量减少[Toomes et al 2004a, Qin et al 2005]。初步研究认为携带FZD4 突变的患者无该症状[Qin et al 2005; Toomes, personal communication]。骨量减少通常需要特定检查或在发生骨折的患者上能被发现。
基因型-表型关联
LRP5 基因突变体通常表现有骨量减少(dual x-ray absorptiometry (DXA)双能X线吸收法检查) [Toomes et al 2004a, Qin et al 2005]。
可能的FEVR遗传复杂性. 同时携带FZD4 (c.1250G>A; p.Arg417Gln)和LRP5 (c.1330C>T; p.Arg444Cys)顺式突变时对应严重表型,比起单个FZD4基因突变体[Qin et al 2005]。四分之三的受累的 家系成员可致盲,而四分之三单个FZD4基因突变携带者可无症状,这表明基因的协同致病作用与表型的关系[Qin et al 2005]。
在一个携带FZD4 c.1463G>A (p.Gly488Asp)变异的家系中,1位受累的个体检出c.205C>T (p.His69Tyr) 反式突变体,表现为严重的视力表型,比起家系中仅携带p.Gly488Asp的个体[Kondo et al 2003]。p.His69Tyr变异在对照人群和其他adFEVR家系成员样本中有检出Omoto et al 2004]。 Omoto et al [2004]报道1名6岁严重表型的先证者,然而其母亲和同胞则临床表型较轻。
既往关于 factor V Leiden 突变可对表型具有修饰作用的研究未被证实,FZD4 基因c.1502delCT 突变和factor V Leiden突变对应严重表型说明了factor V Leiden 仍具有修饰作用[Shastry & Trese 2004]。然而,也有研究报道,相同突变伴有严重表型但未发现Leiden突变 [Bottomley et al 2006],说明该两个突变的共分离可能仅为偶然,该结论也被Bottomley et al [2006]研究支持。
外显率
当用血管荧光造影检查时,外显率为100%,由于几乎所有患者都伴有外周视网膜无血管表现 [Ober et al 1980]。
当用间接眼检镜检查来判断临床表现程度时,外显率为90%[van Nouhuys 1982]。
当用视力或其他临床表现来判断疾病严重程度时,外显率可低至10%。
患病率
FEVR被认为罕见,暂无患病率数据。然而分子遗传学检测的开展证实了90%的患者并无临床症状,因此该病实际患病率不好确认。
FEVR可见于大多数民族。
基因关联疾病
LRP5 突变可导致两种常染色体隐性遗传疾病:
- 神经胶质瘤综合征(OPPG) (OMIM 259770) [Gong et al 2001]
LRP5基因前几个外显子的错义突变与 常染色体显性遗传 高骨量表型相关:
鉴别诊断
FEVR 有常染色体显性遗传,常染色体隐性遗传或 X-linked遗传模式,不能但从临床检查区分。
- 常显FEVR 最为常见。
- 常隐FEVR由LRP5突变导致。 [Shastry & Trese 1997, de Crecchio et al 1998, Jiao et al 2004] (see Genetically Related Disorders).
- X连锁FEVR属于 NDP-related retinopathies视网膜病表型之一,NDP-related retinopathies视网膜病表型还包括Norrie disease[Chen et al 1993]。
Incontinentia pigmenti色素失禁症 (IP)是一组 X-linked dominant X连锁显性遗传疾病,累及皮肤、毛发、牙齿、指甲和眼。眼表型与FEVR类似,然而其他表型可与FEVR鉴别。
类似adFEVR的获得性疾病
- 早产儿视网膜病变(ROP) 一类散发性疾病,表型类似FEVR。ROP 以周围视网膜无血管生成,早产导致视网膜血管无法生成,在一些ROP婴幼儿病例,视网膜新生血管和瘢痕后遗症与FEVR类似。早产史可鉴别。
- 渗出性视网膜病,持续性胎儿血管综合征,弓蛔虫病也与FEVR 表型类似,包括外周视网膜维管束增多,晶状体后膜和渗出性脱落。
- 渗出性视网膜病 (OMIM 300216) 以严重的毛细血管扩张为主要表现,眼底异常血管,大量渗出导致视网膜脱落,男性患儿单侧受累多见。
- 持续性胎儿血管综合征或持续性增生性原发性玻璃体(PHPV) 以Norrie 病晶状体后维管组织膜增生为主要表现(see NDP-Related Retinopathies)。在足月婴儿中可观察到,由于玻璃样血管系统未能退化所致,通常单侧受累,也课件双侧受累,通常是散发性但偶尔家族性。与FEVR相反,受累的眼睛通常表现小眼。一些FEVR患者的临床特征也表现为异常的透明质动脉消退,这一过程被认为是PHPV的生理基础。[Downey et al 2006]报道在一个常染色体隐性遗传FEVR家系中,受累的家庭成员伴有视盘成簇胶质组织或后极至晶状体中央玻璃不透明,提示持续透明动脉形成。
- 弓蛔虫病 is an acquired单侧获得性感染性疾病,感染了圆蠕虫犬弓蛔虫,有一种表现形式为外周视网膜肉芽肿形成,导致视网膜牵引、折叠,可伴在FEVR不出现的葡萄膜炎。
疾病管理
首诊后的评估
常染色体显性遗传 家族性adFEVR诊断建立后,需行以下评估:
- 眼科检查,包括间接眼检镜检查和巩膜压痕检查。
- 荧光素眼底造影可增加对无症状受累个体外周无血管检出率[Ober et al 1980]。
对症治疗
视网膜无血管本身无特殊治疗方法,然而,其导致的缺血、视网膜新血管形成可采用预防性冷冻治疗或氩激光光凝术来诱导新生血管生成,类似疗法还可用于视网膜空洞和视网膜渗出以防止视网膜剥离。
传统的治疗方法是通过手术治疗视网膜牵拉所产生的孔源性视网膜脱离,但预后可能较谨慎。
渗出性视网膜脱离可用冷冻治疗来稳定,但预后较差。
首发症状的预防
已有治疗方法不能预防外周视网膜无血管弓形异常。
继发并发症的预防
FEVR患者骨量可能减少,可通过用药改善,然而长期随访增加骨量的治疗数据仍较欠缺[Downey et al 2006]。
监测
有家族病史的儿童应定期接受眼底检查,以评估视网膜新生血管、牵拉或渗出液的发展。
无症状的小范围外周无血供的个体可能只需要每年复查一次,对于活跃的新生血管或渗出物可能需要治疗和密切观察。
视网膜牵拉术患者需要根据临床结果的稳定性定期复查,复查频率因人而异。
亲属患病风险评估
存在患病风险的亲属可以从眼底检查中获益,理想情况下,还可以通过荧光素眼底血管造影来识别任何特征性病变。预防性的周围视网膜消融激光光凝或冷冻疗法取决于个体年龄和病变的进展。
如果在 受累的家系中检出致病性变异,对于有患病风险的亲属可施行分子遗传学检测,而无家族特异性突变检出的家系患者亲属一般无需常规眼科检查。
患病风险亲属遗传咨询参见Genetic Counseling。
在研治疗
血管内皮生长因子(VEGF)抑制剂是目前广泛用于获得性视网膜疾病的新血管或渗出药物,。一项尚未发表的研究提供了6名患有FEVR和威胁视力的视网膜新生血管和渗出物的儿童的信息,这些儿童未能通过常规治疗稳定下来[Drenser 2006],[Drenser 2006]。玻璃体内注射聚乙二醇帕塔尼钠可使渗出液持续减少6个月以上;然而,视网膜牵拉继续进展;在一些人看来,这似乎是由VEGF抑制引起的。VEGF抑制剂对眼睛的长期影响以及VEGF抑制对儿童人群的影响目前尚不清楚。
临床试验信息参见ClinicalTrials.gov。
遗传咨询
遗传咨询是一个给患者及家属提供关于遗传性疾病本质、遗传特性以及影响并帮助他们做出知情的医疗决定的过程。下列段落描述遗传风险的评估以及根据家 族史和基因检测判断家族成员遗传状态。本段落描述不适用于解决患者实际面对的个人、文化或伦理问题,也不能代替专业的遗传咨询。—ED.
遗传模式
adFEVR为常染色体显性遗传。
家系患病风险
先证者父母
- 大多数被诊断为adFEVR患者遗传自父母一方突变基因,而携带突变的父母一方可受累或未受累。
- 由于外显率下降,受累患者父母常常无眼部并发症而未得到确诊。
- 突变基因可能是未被鉴定的基因。
- adFEVR先证者可携带新发突变基因,然而新发突变基因占比仍未知。
先证者同胞
- 先证者同胞患病风险取决于先证者父母遗传状态。
- 如果先证者携带致病性基因突变,同胞将有50%概率遗传到变异。
- 如果同胞遗传了致病突变,也不能预测是否将会出现症状,如果出现,也不能预测起病年龄和症状严重程度。
- 早期研究表明,多达90%的adFEVR患者可能没有症状。
- 如果先证者未检出致病性变异,同时父母表型正常,同胞患病风险极低。
- 暂无胚系嵌合报道,但有可能性。
先证者子代
- 子代有50%概率遗传到致病突变。
- 一旦子代遗传到致病突变,也不能预测是否会有症状出现,如果症状出现,也不能预测症状出现年龄和严重程度。
- 超过90%adFEVR患者无症状。
先证者家系其他成员 患病风险取决于先证者父母,如果先证者父母携带致病突变,家系成员则有患病风险。
遗传咨询相关问题
参见疾病管理, Evaluation of Relatives at Risk 亲属患病风险评估,以早诊断和治疗。
复杂遗传模式FEVR 暂无明确证据,有研究表明FEVR遗传模式复杂(see Genotype-Phenotype Correlations)。
外显率下降的遗传咨询 外显率下降可能和未鉴定出的基因有关,难以明确致病基因的遗传,早期的研究认为50%患者无症状[Benson 1995],然而,后续研究数据为90%,更多研究仍需继续讨论外显率与突变的关系。
基因异质性遗传咨询 单凭眼科检查无法区别常染色体显性遗传,常染色体隐性遗传和 X-linked遗传,对特殊的家系难以判断,对散发病例更难判断。
对于新发突变在家系中的考虑 当先证者父母无表型也未检出致病性变异时,先证者可能存在新发突变或外显率下降,然而,也要考虑非生物学父亲或代孕、领养等情况需要被考虑。
家庭计划
- 怀孕前是讨论患病风险和产前诊断的最佳时机。
- 对受累的年轻成人进行遗传咨询是合适的(包括评估子代患病风险和讨论生育计划)
基因库 DNA 库用于存储DNA(通常为提取自白细胞DNA)已被将来之需,我们对基因、等位基因突变的理解、对疾病的认识以及检测方法都将提升,应考虑对患者DNA进行保存。
产前诊断
一旦致病性变异检出,羊膜细胞提取DNA可用于产前诊断(通常在妊娠15-18周),绒毛取样则可在10-12周。
注意:孕周可以从最后一个正常月经期的第一天开始计算,也可以通过超声波测量来计算。
对adFEVR等病症进行产前检查的要求并不常见。在使用产前检查方面,医学专业人员和家庭内部可能存在着不同的看法,特别是在考虑进行产前检查的目的是终止妊娠而不是早期诊断的情况下。虽然大多数中心认为产前检查的决定是父母的选择,但讨论这些问题是适当的。
胚胎植入前遗传学诊断 (PGD) 一些检出致病性突变的家庭可考虑。
资源
GeneReviews工作人员已经筛选了以下专科疾病和患者帮扶组织 ,注册登记能使患者及其家庭获益。 GeneReviews对该类组织提供的信息不负责,信息的筛选标准,参见此处 ( here)。
- FEVR.NET (Familial Exudative Vitreoretinopathy)Email: young1@fevr.net
- National Eye Institute31 Center DriveMSC 2510Bethesda MD 20892-2510Phone: 301-496-5248Email: 2020@nei.nih.gov
- Retina InternationalRetina SuisseAusstellungsstrasse 36Zurich CH-8005SwitzerlandPhone: +41 (0) 44 444 1077Fax: +41 (0) 44 444 1070Email: christina.fasser@retina-international.org
- American FEVR Research Consortium RegistryMoran Eye Center, University of Utah65 Medical DriveRoom 6620-CSalt Lake City UT 84112Phone: 800-824-2073 ext 51297; 801-585-1297Fax: 801-587-7686Email: jennifer.harmon@hsc.utah.edu
- eyeGENE - National Ophthalmic Disease Genotyping Network RegistryPhone: 301-435-3032Email: eyeGENEinfo@nei.nih.gov
分子遗传学
分子遗传学检测的信息和OMIM相关列表可能同其它GeneReview信息会有不同。(可能有更新原因)—ED.
Table A.
adFEVR:基因和数据库
| 定位命名 | 基因 | 染色体位置 | 蛋白 | 专业数据库 | HGMD |
|---|---|---|---|---|---|
| EVR1 | FZD4 | 11q14 | Frizzled-4 | FZD4 database | FZD4 |
| EVR3 | Unknown | 11p13-p12 | Unknown | ||
| EVR4 | LRP5 | 11q13 | Low-density lipoprotein receptor-related protein 5 | LRP5 @ LOVD | LRP5 |
| EVR5 | TSPAN12 | 7q31 | Tetraspanin-12 | TSPAN12 @ LOVD | TSPAN12 |
Table B.
OMIM收录词条(View All in OMIM)
| 133780 | EXUDATIVE VITREORETINOPATHY 1; EVR1 |
| 601813 | EXUDATIVE VITREORETINOPATHY 4; EVR4 |
| 603506 | LOW DENSITY LIPOPROTEIN RECEPTOR-RELATED PROTEIN 5; LRP5 |
| 604579 | FRIZZLED, DROSOPHILA, HOMOLOG OF, 4; FZD4 |
| 605750 | EXUDATIVE VITREORETINOPATHY 3; EVR3 |
| 613138 | TETRASPANIN 12; TSPAN12 |
| 613310 | EXUDATIVE VITREORETINOPATHY 5; EVR5 |
分子遗传学致病机制
adFEVR的主要病理过程被认为是过早的视网膜血管生成/血管生成或视网膜血管分化阻断,导致不完整的周边视网膜的血管化。迄今为止,已有4个基因的突变导致FEVR:NDP(编码norrin) (OMIM 300658) (x连锁参见NDP相关疾病)、FZD4(显性)、LRP5(显性和隐性)和TSPAN12(显性)。每个编码的蛋白质是一个组件的norrin /β-catenin信号通路(也称为norrin / frizzled-4途径),在这一途径中,配体norrin与受体frizzld -4、共同受体低密度脂蛋白受体相关蛋白-5和辅助蛋白tetraspanin-12组成的受体复合物结合。在没有norrin结合的情况下,信号不会被激活。这导致细胞质β-catenin成为磷酸化通过ubiquitin-proteasome通路和靶向退化。因此,目标基因仍然受到抑制,信号是由norrin结合到frizzed -4, LRP5和TSPAN12受体复合物而激活的,这个复杂的触发信号抑制β-catenin的破坏,允许其胞质水平增加。随后,β-catenin进入细胞核,它与T细胞因子(TCF) /淋巴增强因子(LEF)转录因子家族norrin目标基因的表达。这对Wnt信号通路有很多相似之处,β-catenin途径由norrin代替Wnt配体,以及没有与Wnt tetraspanins /β-catenin信号。因此,鉴定新的FEVR相关基因可为发现这一重要信号通路的新成员提供了一个重要的途径 [Xu et al 2004, Junge et al 2009, Ye et al 2010]。
FZD4
基因结构 FZD4 mRNA有7,394 bp,由两个外显子组成。详见:Table A, 基因.
致病性等位基因变异 FZD4突变类型包括错义突变、无义突变、插入、缺失,但暂未见剪接突变。大部分缺失和插入导致 mRNA移码错误,但是异常mRNAs是否由无义介导的衰变或是产生了提前终止蛋白仍是未知。
Table 2.
FZD4 基因部分致病性变异
| DNA 核酸改变 | 蛋白氨基酸改变 | 参考序列 |
|---|---|---|
| c.1250G>A 1 | p.Arg417Gln | NM_012193 NP_036325 |
| c.205C>T 2 | p.His69Tyr | |
| c.1463G>A | p.Gly488Asp | |
| c.1501_1502delCT | p.Leu501SerfsTer533 |
变异的分级:列表中变异由作者提供, GeneReviews工作人员未对变异进行独立分级。
命名:遵循Human Genome Variation Society (varnomen
- .hgvs.org ).1. 顺式LRP5c.1330C>T 突变关联较重表型(参见Genotype-Phenotype Correlations,复杂遗传模式的FEVR)。
2. 反式排列c.1463G>A 突变关联眼表型 (参见 Genotype-Phenotype Correlations,复杂遗传模式的FEVR)。
正常基因产物 编码537氨基酸蛋白frizzled-4,由7个跨膜受体组成,属于WNT蛋白家族[Huang & Klein 2004]。然而,frizzled-4是唯一参与调控norrin/β-catenin信号通路的蛋白,有研究表明该通路由norrin激发而不是Wnt配体-受体复合物frizzled-4, LRP5和tetraspanin12 [Xu et al 2004, Junge et al 2009]。
异常基因产物 frizzled-4多数突变导致提前终止密码子(PTCs)。导致单倍剂量不足,由无义介导的衰变(nonsense-mediated mRNA decay),然而, PTC并未伴随下游内含子,以防止产生移码突变。mRNAs可逃逸该过程,使其翻译成截短蛋白。frizzled-4的PTCs机制尚未明确阐释,异常基因如何产生也未明确。然而,1项研究表明, frizzled-4 protein (p.Leu501fsTer533) 变异并非定位于细胞膜蛋白,而是在内质网中表达[Robitaille et al 2002, Kaykas et al 2004],该突变同时影响野生型蛋白,从而导致显性负效作用 [Kaykas et al 2004]。
大部分frizzled-4 错义都位于功能区,说明其可影响蛋白功能,比如,体外实验已表明CRD 结构域 错义突变(p.Met105Val and p.Met157Val) 减少rfrizzled-4与norrin结合能力并激活β-catenin pathway [Xu et al 2004]。
LRP5
基因结构 LRP5 mRNA 长5,161 bp,包含23个外显子,详见Table A,基因
致病性变异 LRP5 突变类型包括 错义 、无义、插入、缺失和剪接突变。大部分缺失、插入和剪接导致移码,大部分缺失和插入导致 mRNA移码错误,但是异常mRNAs是否由无义介导的衰变或是产生了提前终止蛋白仍是未知。
Table 3.
LRP5部分致病性变异
| DNA 核酸改变 | 蛋白氨基酸改变 | 参考序列 |
|---|---|---|
| c.518C>T | p.Thr173Met | NM_002335 NP_002326 |
| c.1330C>T | p.Arg444Cys 1 | |
| c.4081T>G | p.Cys1361Gly | |
| c.4099G>A | p.Glu1367Lys | |
| c.3502T>C | p.Tyr1168His |
命名:遵循Human Genome Variation Society (varnomen
- .hgvs.org ).1. 顺式 FZD4c.1250G>A 突变关联较重表型 (参见 Genotype-Phenotype Correlations,复杂遗传模式的FEVR)。
正常 基因产物 LRP5 编码1,615个氨基酸单跨膜受体,又名低密度脂蛋白关联白蛋-5,与frizzled受体 (如frizzled-4)结合Wnt蛋白 [He et al 2004]。 LRP5 参与调控norrin/β-catenin信号通路。有研究表明该通路由norrin激发而不是Wnt配体-受体复合物frizzled-4, LRP5和tetraspanin12。
异常基因产物 LRP5 突变是由于单倍剂量不足,多数无义突变和移码突变可导致无义介导的衰变或提前蛋白终止,然而,暂无明确证据。体外细胞实验证实adFEVR 错义 突变 p.Tyr1168His and p.Cys1361Gly 影响β-catenin信号通路转导, 但是,另两个adFEVR关联突变 (p.Thr173Met and p.Glu1367Lys) 则无效应。当adFEVR关联突变p.Thr173Met, p.Glu1367Lys, p.Tyr1168His和 p.Cys1361Gly与野生型 LRP5 蛋白共同转染时,野生型Wnt/β-catenin信号通路并未受影响,使得显性负效仍有争论[Ai et al 2005]。
TSPAN12
基因结构 TSPAN12 mRNA 长2579,包含8个外显子,详见Table A,基因。
致病性变异 TSPAN12 突变类型包括错义 、无义、插入、缺失和剪接突变, 大部分缺失和插入导致 mRNA移码错误,但是异常mRNAs是否由无义介导的衰变或是产生了提前终止蛋白仍是未知。
Table 4.
TSPAN12基因部分致病性变异
| DNA核酸改变 | 蛋白氨基酸改变 | 参考序列 |
|---|---|---|
| c.709G>C | p.Ala237Pro 1 | NM_012338 NP_036470 |
变异的分级:列表中变异由作者提供, GeneReviews工作人员未对变异进行独立分级。
命名:遵循Human Genome Variation Society (varnomen
- .hgvs.org ).1. 荷兰人群常见
正常基因产物 TSPAN12 编码305个氨基酸,包含4个跨膜结构域,又名tetraspanin12,组成norrin-LRP5-FZD4复合物,细胞实验证实其参与norrin/β-catenin信号转导 [Junge et al 2009]。
参考文献
文献引用
- Ai M, Heeger S, Bartels CF, Schelling DK. Clinical and molecular findings in osteoporosis-pseudoglioma syndrome. Am J Hum Genet. 2005;77:741 - 53. [PMC free article: PMC1271384] [PubMed: 16252235]
- Benson WE. Familial exudative vitreoretinopathy. Trans Am Ophthalmol Soc. 1995;93:473 - 521. [PMC free article: PMC1312071] [PubMed: 8719692]
- Boonstra FN, van Nouhuys CE, Schuil J, de Wijs IJ, van der Donk KP, Nikopoulos K, Mukhopadhyay A, Scheffer H, Tilanus MA, Cremers FP, Hoefsloot LH. Clinical and molecular evaluation of probands and family members with familial exudative vitreoretinopathy. Invest Ophthalmol Vis Sci. 2009;50:4379 - 85. [PubMed: 19324841]
- Bottomley HM, Downey LM, Inglehearn CF, Toomes C. Comment on 'cosegregation of two unlinked mutant alleles in some cases of autosomal dominant familial exudative vitreoretinopathy'. Eur J Hum Genet. 2006;14:6 - 7. [PubMed: 16319824]
- Boyden LM, Mao J, Belsky J, Mitzner L, Farhi A, Mitnick MA, Wu D, Insogna K, Lifton RP. High bone density due to a mutation in LDL-receptor-related protein 5. N Engl J Med. 2002;346:1513 - 21. [PubMed: 12015390]
- Chen ZY, Battinelli EM, Fielder A, Bundey S, Sims K, Breakefield XO, Craig IW. A mutation in the Norrie disease gene (NDP) associated with X-linked familial exudative vitreoretinopathy. Nat Genet. 1993;5:180 - 3. [PubMed: 8252044]
- de Crecchio G, Simonelli F, Nunziata G, Mazzeo S, Greco GM, Rinaldi E, Ventruto V, Ciccodicola A, Miano MG, Testa F, Curci A, D'Urso M, Rinaldi MM, Cavaliere ML, Castelluccio P. Autosomal recessive familial exudative vitreoretinopathy: evidence for genetic heterogeneity. Clin Genet. 1998;54:315 - 20. [PubMed: 9831343]
- Downey LM, Bottomley HM, Sheridan E, Ahmed M, Gilmour DF, Inglehearn CF, Reddy A, Agrawal A, Bradbury J, Toomes C. Reduced bone mineral density and hyaloid vasculature remnants in a consanguineous recessive FEVR family with a mutation in LRP5. Br J Ophthalmol. 2006;90:1163 - 7. [PMC free article: PMC1857417] [PubMed: 16929062]
- Downey LM, Keen TJ, Roberts E, Mansfield DC, Bamashmus M, Inglehearn CF. A new locus for autosomal dominant familial exudative vitreoretinopathy maps to chromosome 11p12-13. Am J Hum Genet. 2001;68:778 - 81. [PMC free article: PMC1274490] [PubMed: 11179025]
- Drenser KA. Pharmacologic therapy for pediatric retinal vascular disease. Las Vegas, NV: The Annual Meeting of the American Academy of Ophthalmology; 2006.
- Drenser KA, Dailey W, Vinekar A, Dalal K, Capone A, Trese MT. Clinical presentation and genetic correlation of patients with mutations affecting the FZD4 gene. Arch Ophthalmol. 2009;127:1649 - 54. [PubMed: 20008721]
- Gong Y, Slee RB, Fukai N, Rawadi G, Roman-Roman S, Reginato AM, Wang H, Cundy T, Glorieux FH, Lev D, Zacharin M, Oexle K, Marcelino J, Suwairi W, Heeger S, Sabatakos G, Apte S, Adkins WN, Allgrove J, Arslan-Kirchner M, Batch JA, Beighton P, Black GC, Boles RG, Boon LM, Borrone C, Brunner HG, Carle GF, Dallapiccola B, De Paepe A, Floege B, Halfhide ML, Hall B, Hennekam RC, Hirose T, Jans A, Juppner H, Kim CA, Keppler-Noreuil K, Kohlschuetter A, LaCombe D, Lambert M, Lemyre E, Letteboer T, Peltonen L, Ramesar RS, Romanengo M, Somer H, Steichen-Gersdorf E, Steinmann B, Sullivan B, Superti-Furga A, Swoboda W, van den Boogaard MJ, Van Hul W, Vikkula M, Votruba M, Zabel B, Garcia T, Baron R, Olsen BR, Warman ML. LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell. 2001;107:513 - 23. [PubMed: 11719191]
- He X, Semenov M, Tamai K, Zeng X. LDL receptor-related proteins 5 and 6 in Wnt/beta-catenin signaling: arrows point the way. Development. 2004;131:1663 - 77. [PubMed: 15084453]
- Huang HC, Klein PS. The Frizzled family: receptors for multiple signal transduction pathways. Genome Biol. 2004;5:234. [PMC free article: PMC463283] [PubMed: 15239825]
- Jia LY, Li XX, Yu WZ, Zeng WT, Liang C. Novel frizzled-4 gene mutations in chinese patients with familial exudative vitreoretinopathy. Arch Ophthalmol. 2010;128:1341 - 9. [PubMed: 20938005]
- Jiao X, Ventruto V, Trese MT, Shastry BS, Hejtmancik JF. Autosomal recessive familial exudative vitreoretinopathy is associated with mutations in LRP5. Am J Hum Genet. 2004;75:878 - 84. [PMC free article: PMC1182117] [PubMed: 15346351]
- Junge HJ, Yang S, Burton JB, Paes K, Shu X, French DM, Costa M, Rice DS, Ye W. TSPAN12 regulates retinal vascular development by promoting Norrin- but not Wnt-induced FZD4/beta-catenin signaling. Cell. 2009;139:299 - 311. [PubMed: 19837033]
- Kaykas A, Yang-Snyder J, Heroux M, Shah KV, Bouvier M, Moon RT. Mutant Frizzled 4 associated with vitreoretinopathy traps wild-type Frizzled in the endoplasmic reticulum by oligomerization. Nat Cell Biol. 2004;6:52 - 8. [PubMed: 14688793]
- Kondo H, Hayashi H, Oshima K, Tahira T, Hayashi K. Frizzled 4 gene (FZD4) mutations in patients with familial exudative vitreoretinopathy with variable expressivity. Br J Ophthalmol. 2003;87:1291 - 5. [PMC free article: PMC1920788] [PubMed: 14507768]
- Kondo H, Kusaka S, Yoshinaga A, Uchio E, Tawara A, Hayashi K, Tahira T. Mutations in the TSPAN12 gene in Japanese patients with familial exudative vitreoretinopathy. Am J Ophthalmol. 2011;151:1095 - 1100. [PubMed: 21334594]
- Little RD, Carulli JP, Del Mastro RG, Dupuis J, Osborne M, Folz C, Manning SP, Swain PM, Zhao SC, Eustace B, Lappe MM, Spitzer L, Zweier S, Braunschweiger K, Benchekroun Y, Hu X, Adair R, Chee L, FitzGerald MG, Tulig C, Caruso A, Tzellas N, Bawa A, Franklin B, McGuire S, Nogues X, Gong G, Allen KM, Anisowicz A, Morales AJ, Lomedico PT, Recker SM, Van Eerdewegh P, Recker RR, Johnson ML. A mutation in the LDL receptor-related protein 5 gene results in the autosomal dominant high-bone-mass trait. Am J Hum Genet. 2002;70:11 - 9. [PMC free article: PMC419982] [PubMed: 11741193]
- MacDonald ML, Goldberg YP, Macfarlane J, Samuels ME, Trese MT, Shastry BS. Genetic variants of frizzled-4 gene in familial exudative vitreoretinopathy and advanced retinopathy of prematurity. Clin Genet. 2005;67:363 - 6. [PubMed: 15733276]
- Miyakubo H, Hashimoto K, Miyakubo S. Retinal vascular pattern in familial exudative vitreoretinopathy. Ophthalmology. 1984;91:1524 - 30. [PubMed: 6084219]
- Nallathambi J, Shukla D, Rajendran A, Namperumalsamy P, Muthulakshmi R, Sundaresan P. Identification of novel FZD4 mutations in Indian patients with familial exudative vitreoretinopathy. Mol Vis. 2006;12:1086 - 92. [PubMed: 17093393]
- Nikopoulos K, Venselaar H, Collin RW, Riveiro-Alvarez R, Boonstra FN, Hooymans JM, Mukhopadhyay A, Shears D, van Bers M, de Wijs IJ, van Essen AJ, Sijmons RH, Tilanus MA, van Nouhuys CE, Ayuso C, Hoefsloot LH, Cremers FP. Overview of the mutation spectrum in familial exudative vitreoretinopathy and Norrie disease with identification of 21 novel variants in FZD4, LRP5, and NDP. Hum Mutat. 2010a;31:656 - 66. [PubMed: 20340138]
- Nikopoulos K, Gilissen C, Hoischen A, van Nouhuys CE, Boonstra FN, Blokland EA, Arts P, Wieskamp N, Strom TM, Ayuso C, Tilanus MA, Bouwhuis S, Mukhopadhyay A, Scheffer H, Hoefsloot LH, Veltman JA, Cremers FP, Collin RW. Next-generation sequencing of a 40 Mb linkage interval reveals TSPAN12 mutations in patients with familial exudative vitreoretinopathy. Am J Hum Genet. 2010b;86:240 - 7. [PMC free article: PMC2820179] [PubMed: 20159111]
- Ober RR, Bird AC, Hamilton AM, Sehmi K. Autosomal dominant exudative vitreoretinopathy. Br J Ophthalmol. 1980;64:112 - 120. [PMC free article: PMC1039360] [PubMed: 7362811]
- Omoto S, Hayashi T, Kitahara K, Takeuchi T, Ueoka Y. Autosomal dominant familial exudative vitreoretinopathy in two Japanese families with FZD4 mutations (H69Y and C181R). Ophthalmic Genet. 2004;25:81 - 90. [PubMed: 15370539]
- Poulter JA, Ali M, Gilmour DF, Rice A, Kondo H, Hayashi K, Mackey DA, Kearns LS, Ruddle JB, Craig JE, Pierce EA, Downey LM, Mohamed MD, Markham AF, Inglehearn CF, Toomes C. Mutations in TSPAN12 cause autosomal-dominant familial exudative vitreoretinopathy. Am J Hum Genet. 2010;86:248 - 53. [PMC free article: PMC2820188] [PubMed: 20159112]
- Qin M, Hayashi H, Oshima K, Tahira T, Hayashi K, Kondo H. Complexity of the genotype-phenotype correlation in familial exudative vitreoretinopathy with mutations in the LRP5 and/or FZD4 genes. Hum Mutat. 2005;26:104 - 12. [PubMed: 15981244]
- Robitaille J, MacDonald ML, Kaykas A, Sheldahl LC, Zeisler J, Dube MP, Zhang LH, Singaraja RR, Guernsey DL, Zheng B, Siebert LF, Hoskin-Mott A, Trese MT, Pimstone SN, Shastry BS, Moon RT, Hayden MR, Goldberg YP, Samuels ME. Mutant frizzled-4 disrupts retinal angiogenesis in familial exudative vitreoretinopathy. Nat Genet. 2002;32:326 - 30. [PubMed: 12172548]
- Robitaille JM, Zheng B, Wallace K, Beis MJ, Tatlidil C, Yang J, Sheidow TG, Siebert L, Levin AV, Lam WC, Arthur BW, Lyons CJ, Jaakkola E, Tsilou E, Williams CA, Weaver RG, Shields CL, Guernsey DL. The role of Frizzled-4 mutations in familial exudative vitreoretinopathy and Coats disease. Br J Ophthalmol. 2011;95:574 - 9. [PubMed: 21097938]
- Shastry BS, Trese MT. Familial exudative vitreoretinopathy: further evidence for genetic heterogeneity. Am J Med Genet. 1997;69:217 - 8. [PubMed: 9056564]
- Shastry BS, Trese MT. Cosegregation of two unlinked mutant alleles in some cases of autosomal dominant familial exudative vitreoretinopathy. Eur J Hum Genet. 2004;12:79 - 82. [PubMed: 14560311]
- Shukla D, Singh J, Sudheer G, Soman M, John RK, Ramasamy K, Perumalsamy N. Familial exudative vitreoretinopathy (FEVR). Clinical profile and management. Indian J Ophthalmol. 2003;51:323 - 8. [PubMed: 14750620]
- Tasman W, Augsburger JJ, Shields JA, Caputo A, Annesley WH. Familial exudative vitreoretinopathy. Trans Am Ophthalmol Soc. 1981;79:211 - 26. [PMC free article: PMC1312184] [PubMed: 7342402]
- Toomes C, Bottomley HM, Jackson RM, Towns KV, Scott S, Mackey DA, Craig JE, Jiang L, Yang Z, Trembath R, Woodruff G, Gregory-Evans CY, Gregory-Evans K, Parker MJ, Black GC, Downey LM, Zhang K, Inglehearn CF. Mutations in LRP5 or FZD4 underlie the common familial exudative vitreoretinopathy locus on chromosome 11q. Am J Hum Genet. 2004a;74:721 - 30. [PMC free article: PMC1181948] [PubMed: 15024691]
- Toomes C, Bottomley HM, Scott S, Mackey DA, Craig JE, Appukuttan B, Stout JT, Flaxel CJ, Zhang K, Black GC, Fryer A, Downey LM, Inglehearn CF. Spectrum and frequency of FZD4 mutations in familial exudative vitreoretinopathy. Invest Ophthalmol Vis Sci. 2004b;45:2083 - 90. [PubMed: 15223780]
- van Nouhuys CE. Dominant exudative vitreoretinopathy and other vascular developmental disorders of the peripheral retina. Doc Ophthalmol. 1982;54:1 - 414. [PubMed: 6897033]
- van Nouhuys CE. Signs, complications, and platelet aggregation in familial exudative vitreoretinopathy. Am J Ophthalmol. 1991;111:34 - 41. [PubMed: 1985487]
- Van Wesenbeeck L, Cleiren E, Gram J, Beals RK, Benichou O, Scopelliti D, Key L, Renton T, Bartels C, Gong Y, Warman ML, De Vernejoul MC, Bollerslev J, Van Hul W. Six novel missense mutations in the LDL receptor-related protein 5 (LRP5) gene in different conditions with an increased bone density. Am J Hum Genet. 2003;72:763 - 71. [PMC free article: PMC1180253] [PubMed: 12579474]
- Xu Q, Wang Y, Dabdoub A, Smallwood PM, Williams J, Woods C, Kelley MW, Jiang L, Tasman W, Zhang K, Nathans J. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 2004;116:883 - 95. [PubMed: 15035989]
- Ye X, Wang Y, Nathans J. The Norrin/Frizzled4 signaling pathway in retinal vascular development and disease. Trends Mol Med. 2010;16:417 - 25. [PMC free article: PMC2963063] [PubMed: 20688566]
推荐阅读
- Toomes C, Downey LM, Bottomley HM, Mintz-Hittner HA, Inglehearn CF. Further evidence of genetic heterogeneity in familial exudative vitreoretinopathy; exclusion of EVR1, EVR3, and EVR4 in a large autosomal dominant pedigree. Br J Ophthalmol. 2005;89:194 - 7. [PMC free article: PMC1772516] [PubMed: 15665352]
章节注释
修订历史
- 22 September 2011 (cd) Revision: 序列分析 of TSPAN12 available clinically
- 14 July 2011 (me) Comprehensive update posted live
- 11 December 2008 (cd) Revision: clinical and prenatal testing available for mutations in LRP5 and FZD4; prenatal testing available for mutations in FZD4
- 28 August 2008 (cd) Revision: 序列分析 available clinically
- 27 August 2007 (me) Comprehensive update posted to live Web site
- 21 March 2005 (me) Review posted to live Web site
- 9 September 2004 (ct) Original submission