概要
临床特征
RNA聚合酶III相关的白质营养不良, 为低髓鞘性白质营养不良,并伴随一些脑部核磁共振成像的共同特点, 以以下三种主要临床发现的不同程度的组合为特征:
-
运动障碍 ( 由痉挛、小脑共济失调和/或震颤导致的渐进性步 态异常)
-
牙齿异常 ( 出牙延迟,缺牙,少牙,和错置或变形)
-
低促性腺激素导致的性腺功能低下
五个重叠的临床表型包括 (在其分子基础搞清楚之前单列如下) :
-
低髓鞘, 先天缺牙,低促性腺激素导致的性腺功能低下 (4H 综合征);
-
共济失调, 出牙延迟,和低髓鞘 (ADDH);
-
震颤-共济失调伴随中枢神经的低髓鞘 (TACH);
-
白质营养不良伴随少牙畸形 (LO); 和
-
低髓鞘伴随小脑营养不良和胼胝体发育不全 (HCAHC).
发病年龄可从婴儿到青春期
诊断/检验
诊断RNA聚合酶III相关的白质营养不良要综合各种经典临床发现, 低髓鞘白质营养不良的脑核磁共振特征, 和POLR3A或POLR3B的双等位基因致病性变异体的存在。若一
岁后相隔六个月的MRI髓鞘成像没显著改善,就可诊断为低髓鞘白质营养不良。
处理
征候处理: 建议多学科团队包括儿神经专家,临床遗传学家, 理疗师,职能治疗师,神经心理学家,牙医,内分泌学家和家庭医生一起处理。移动,吞咽困难和癫痫应由神经和理疗师检测。痉挛的处理可包括去除刺激因素,理 疗和伸展锻炼,口服巴氯芬,注射肉毒杆菌毒素,神经剥离,整形手术,和不太常用的在鞘内放置一 个巴氯芬泵。多涎的处理包括口腔泵吸和行为治疗,胃长宁,抗胆碱药物和/或肉毒杆菌毒素注射, 和手术移位腮腺导管或颌下腺导管伴 随或不伴随舌下腺切除术。必要时,口腔症状可由牙医/口腔科医生处理。低促性腺激素性性腺功能 减退症和其它垂体激素缺陷应咨询内分泌专家处理。
GeneReview Scope
| RNA聚合酶 III相关的白质营养不良: 涵盖的表型1 |
|---|
|
- 1.
- 关于这些表型的其它遗传因素,请见鉴 别诊断。
诊断
综合经典的临床和核磁共振特征与POLR3A或POLR3B致 病性双
等位基因变异体的存在。
主要/共有的临床特征(相关疾病之间有差异的) 是:
-
运动功能障碍: 由痉挛、小脑共济失调和/或震颤导致的渐进性步态异常
-
牙齿异常(e.g., 缺牙, 少牙, 牙齿萌出延迟) [Wolff et al 2010]
-
低促性腺激素导致的性腺功能低下
註:尽管这三项高度提示该诊断,但不是所有特征都出现在有POLR3A或POLR3B致 病性双 等位基因变异体的个体中。
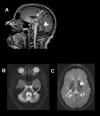
脑核磁共振成像(MRI)的以下特征显示典型的低髓鞘白质营养不良:
-
T2-加权后为中度白质高密度。
-
T1-与灰质结构相比,白质有加权高强度, 等强度, 或轻度低强度信号 [Schiffmann & van der Knaap 2009];
见 图1.
分子遗传检测
基因:POLR3A and POLR3B 是仅有的其双等位基因致病性变异体已知会导 致聚合酶III-相关的白质营养不良的一对基因 [Bernard et al 2011, Saitsu et al 2011, Tétreault et al 2011, Potic et al 2012]。
表 1.
用于聚合酶III-相关的白质营养不良的分子遗传检测的总结
| 基 因 1 | 其 突变占聚合酶III-相关的白质营养不良的百分比 2 | 检 测方法 | 致 病的变异体 3 |
|---|---|---|---|
| POLR3A | 81% | 测序 4 | 序列变异 5, 6 |
| POLR3B | 19% | 测序 4 | 序列变异 5, 6 |
- 1. 见 表 A. 染色体位点和蛋白的基 因和数据库。
- 2. 见 分 子遗传学中等位变异体的信息。
- 3. Bernard et al [2011], Saitsu et al [2011], Tétreault et al [2011], Potic et al [2012]
- 4. 序列分析检 测到的致病性变异体的例子包括基因内小缺失/插入和错义, 无义突变, 以及剪接位点变异体; 通常未见外显子 或全基因 缺失/重复. 至于序列分析中的问题,点击这 里.
-
-
- 5. 用 Sanger测 序测 定外显子和 内含子-外显子 交接处,已检测到POLR3A or POLR3B 中的错义, 无义, 及剪接位点变异体, 缺失, 和插入突变. Bernard et al [2011], Saitsu et al [2011], Tétreault et al [2011], Potic et al [2012].
-
- 6. 至今还没有鉴定到外显子或 全基因缺失或重 复。
-
临床特征
临床类型
聚合酶III-相关的白质营养不良,其脑部MRI共有某些特征,低髓鞘性的白质营养不 良,是三个临床发现不同程度上的总合: 运动障碍, 牙齿发育不良, 和低促性腺激素导致的性腺功能低下.
构成该病的五个临床表型(在其分子基础明了之前被描述为各不相同的) 看起来像是重叠的疾病谱构成的一个连续系列:
-
ADDH. 共济失调, 牙齿发育迟缓, 和低髓鞘 [Wolf et al 2007, Wolff et al 2010]
-
TACH. 震颤共济失调伴随着低中枢髓鞘 [Bernard et al 2010, Bernard et al 2011, Tétreault et al 2011, Tétreault et al 2012]
-
LO. 白质营养不良和少牙 [Atrouni et al 2003, Chouery et al 2011]
-
HCAHC. 低髓鞘伴小脑营养不良和胼胝体发育不全 [Sasaki et al 2009, Saitsu et al 2011]
运动功能障 碍包括渐进性的,由痉挛,小脑共济失调,和/或震颤导致的步态异常。异常可以从轻微(像4H综合 症,HCAHC [Sasaki et al 2009], 和LO中的) 至严重到像TACH和某些4H综合征的个体,早期就不能下床活动的。后者可能源于发现的更为严重的小脑和锥体细胞病变[Bernard et al 2010, Bernard et al 2011]。 有早期症状的孩子可能有更为显著的共济失调和震颤,并不会下床活动或很就早失去该能力。在 其他受累的个体中, 运动症状 (痉挛, 共济失调和锥体细胞以外的功能丧失) 可能首发于青少年或成年早期, 于成年早期失去下床活动能力。
牙齿异常的各种情况中包括牙齿发育迟缓,不全, 少牙, 异常位置或形状的牙萌出[Wolff et al 2010]。 牙齿异常可能会很细微,并没在所有表型中见到 (比如HCAHC)。
低促性腺激素导致的性腺功能低下(HH) 不是恒定的特征: 在 LO 和 HCAHC中没见报道。凡有报道的, HH 的典型表现为青春期发育迟滞或其某些特征迟缓。见于单 发性的低促性腺激素导致的性腺功能低下中的儿童早期HH还没在 聚合酶 III-相关的白质营养不良中报道过。
发生年龄, 在聚合酶III-相关的白质营养不良中不一, 可因表型而异,较为严重的发病会较 早。
-
TACH. 1-5岁发病.
-
4H 综合征. 临床上较轻; 发病在婴儿到青年之间。
在一部分表型中观察到的包括以下其它特征 [Wolf et al 2005, Timmons et al 2006, Vázquez-López et al 2008, Bekiesinska-Figatowska et al 2010, Orcesi et al 2010, Wolff et al 2010, Sato et al 2011, Potic et al 2012]:
-
智力障碍和/或缓慢的认知退化。
-
锥形体外的发现 (e.g., 不同程度和范围从局部到全身性的肌张力障碍); 随着病情加剧,在一些4H综合征和TACH个体中看到 [作者个人观察所见]
-
多涎和吞咽困难. 在4H综合征和ADDH中报道过。报道的最年长4H综合征的人35岁后意外噎死.
-
异常眼外活动
-
在4H综合征, TACH, HCAHC和ADDH中报道有渐进性垂直注 视受限。
-
在TACH, HCAHC 和 4H综合征中有报道凝视诱发的眼震以及异常眼的追逐 和扫视。
-
-
视神经萎缩:在四位TACH个体中描述过。
-
癫痫:在俩4H综合征个体中报道过 [Bernard et al 2011], 一位有HCAHC, 另一位有TACH
-
周围神经病变
-
一些4H综合征患者无症状,但有与正常神经所见?(normal nerve studies - 此处与所引原文有别,待修正 - 译者注) 相关的神经病变 [Timmons et al 2006]。神经活检在电镜下的典型所见包括裂内列满颗粒杂 物,扩大的异常轴突空间,液泡破裂伴随的外包,和失去正常的髓鞘的周 期性。
-
在两例TACH和一例LO神经活检中的所见为正常 [Bernard et al 2010, Bernard et al 2011].
-
HCAHC中没做过神经活检 [Saitsu et al 2011].
-
-
生长激素缺陷; 在一位4H综合征人中报道过 [Potic et al 2012]
-
白内障; 在一位4H综合征人中报道过 [Sato et al 2011]
神经生理研究. 对所有受累个体的EMG和神经传导研究 结果为正常。
基因型-表型相关性
POLR3A
-
TACH个体有其特殊的纯和POLR3A致 病性变异体。
POLR3B.
-
还没发现TACH的个体有POLR3B致病性变异体的。
-
有4H综合征和HCAHC的个体可以有双等位POLR3B致 病性变异体 [Bernard et al 2011, Saitsu et al 2011, Tétreault et al 2011, Potic et al 2012].
流行程度
聚合酶III-相关的白质营养不良其流行程度未知。
但世界各地都有发现 [Atrouni et al 2003, Wolf et al 2005, Timmons et al 2006, Vázquez-López et al 2008, Sasaki et al 2009, Bekiesinska-Figatowska et al 2010, Bernard et al 2010, Orcesi et al 2010, Wolff et al 2010, Bernard et al 2011, Chouery et al 2011, Saitsu et al 2011, Sato et al 2011, Tétreault et al 2011, Potic et al 2012, Tétreault et al 2012].
遗传上相关的 (等位) 疾病
还没有除此GeneReview讨论过的表型外已知与POLR3A or POLR3B的突变相关的疾病。
鉴别诊断
该病的鉴别诊断包括其它低髓鞘白质营养不良。註: 一岁后,间隔至少六个月的两MRI显示髓鞘形成没有显著改善者,可确认为低髓鞘白质营养不良。
参见 白 质营养不良, 低髓鞘: OMIM 表型系列 OMIM中与这些表型相关的基因。
PLP1- 相关疾病, 由PLP1突变所致, 发病年龄多样; 严重程度从一个新生儿表现的 眼球震颤、轴向张力,演进为痉挛性四肢麻 痹、共济失调(Pelizaeus- Merzbacher病)到 后期表现为痉挛性截 瘫(spastic paraparesis,SPG2)。脑部MRI在早发病例中表现为严重低髓鞘, 而在晚发病 的个体中(痉挛性截瘫)没有(或没更为不同的)异常。X-连锁遗传。
Pelizaeus-Merzbacher-样疾病 (低髓鞘白质营养不良-2; HLD-2), 由GJC2 (也叫GJA12) 的双等位突变所致, 发病年龄,严重程度多样。婴幼儿早期发病的较为严重; 晚些发病的有称为SPG44的 spastic paraparesis。脑部MRI所见与PMD中的类似: 弥散性低髓鞘和些许累及脑干, 特别是脑桥。 常染色体隐性遗传.
经 典Cockayne综合征 (CS type I), 由双等位ERCC6 和 ERCC8的致病性变异体所致, 典型的出现在童年早期. 主要临床特征为童年生长不足, 获得性进行性小头畸 形、发育迟缓和衰退或无其它神经系统功能 (比如 痉挛、共济失调、震 颤、癫痫发作和行为异常)。其它可变的症状包括光敏感(三分之二的病例可 见), 脱髓鞘性周围神经病 变, 眼部表现(包括色素 性视网膜病变、白内障)、耳聋、牙齿异常 。脑部MRI表现为低髓鞘或髓 鞘形成延迟, 脑萎缩和 脑钙化. 常染色体隐性遗传.
毛发低硫营养不良(Trichothiodystrophy), 与Cockayne综合征同属 DNA核苷酸切除修复缺陷疾病类, 是一组由ERCC3, GTF2H5, 和 ERCC2的 致病性变异体所致的 常染色体隐性疾病[Takayama et al 1997, Giglia-Mari et al 2004, Kraemer et al 2007]。临床特征多样, 包括以下不同的组合: 脆发(含硫的毛发呈 “虎尾巴”),在光学显微镜下交替出现深色和浅色条纹; 暴露于阳光时皮肤过敏;鱼鳞 病;不孕症;神经系统表现,包括智力障碍、小头畸形、共济失调。脑部MRI 显示 无明显脑萎缩和基底 节钙化的低 髓鞘。
游离唾液酸贮积病 (包括Salla病, 中度Salla病, 和婴幼儿游离唾液酸贮积病(ISSD]) 是由SLC17A5的双等位突 变所致. 严重程度不一; ISSD为最为严重者, 特征是早发的多系统疾病包括 非免疫性胎儿水肿、 肝脾肿大,发育不良,面部粗化,和进行性神经功能恶化导致早期死亡。Salla 病为最轻的, 典型特征是生命开始的前六个月发育正常,然后 肌张力低下,躯干共济失调变得明显。 随着时间的推移渐进,包括发育迟缓, 生长迟缓,严重痉挛和共济失调,进行性面部粗化。中度Salla 病在严重程度谱中位于中间。 脑部MRI表现为 大脑和小脑(有无小 脑萎缩) 的低髓鞘白质营养不良 [Lancaster et al 2005, Linnankivi et al 2006, Benini et al 2012]。 常染色体隐性遗传。
低 髓鞘伴 随先天性白内障 (HCC; 低髓鞘白质营养不良-5[HLD5]) 是由HCC (也叫FAM126A,以前叫DRCTNNB1A) 的致病性变异体导致. 典型发病于婴儿期的先天性白内障 (表现不一) 和心理动作萎缩。周围神经病变出现于多数个体中。脑部MRI显示散漫的低 髓鞘。 一些与T1-加权的低强度相对应地T2- 加权的高强度信号区域可能出现。小脑半球可能表现出中高程度的T2-加 权的信号 ,导致灰白质结合区模糊不清。常染色体隐性遗传。
低髓鞘伴随基底神经节和小脑的营养不良 (HABC, 低髓鞘白质营养不良-6 [HLD6])的标志是早发的运动萎缩和/或迟缓。其特征性的脑部MRI所见:基底神经节和小 脑的渐进性营养不良(特别是 壳核), 有助于区分HABC和其它低髓鞘白质营养不良 [van der Knaap et al 2002, van der Knaap et al 2007]。被认为是常染色体显性 (由全新的致病性变异体) 或隐性导致,但其致病性突变基因还没找到。
18q 缺失综合征, 导致包括18q23的18号染色体长臂远端缺失,
与其它的的髓鞘白质营养不良不同,表现为多系统异常: 形态异常(dysmorphisms), 内分泌异常, 心脏发育畸形, 免疫缺陷, 和
肌肉骨骼畸形 [Kline et al 1993]。神经表现包括发育迟滞,智力障碍,脑萎缩,
行为异常, 癫痫, 锥体和锥体外异常, 张力减退, 协调缺陷, 和眼球震颤[Linnankivi et al 2006,
Miller et al 1990]。两个主要的脑部MRI白质异常是低髓鞘和多焦点
(focal)T2-加权 和 FLAIR 超强信号。脑部结构性的异 常包括: 异托邦、填空性脑室
扩大, 小脑发育不良, 和脑穿通性囊肿。白
质异常被认为是18q23区域的MBP(编码髓鞘基质蛋白,中枢神经白质的一个重要蛋白质)单倍体不足的次生病变。
Fucosidosis 是由FUCA1双等位致病性变异体导致。一型 Fucosidosis与其它低髓鞘白质营养不良在临床上的不同在于 有粗糙的五官,肝脾 肿大,心脏扩大。 二型Fucosidosis的区分常常以轻度粗糙,生长发育迟缓和弥漫性躯体性血管角化 瘤 [Durand et al 1969, Kousseff et al 1976]. 脑部MRI显示为 独特的低髓鞘图案,随着时间的推 移累及大脑和小脑萎缩,伴随苍白球、黑质、丘脑低信号。 常染色体隐性遗传。
早期髓鞘化结构的低髓鞘(HEMS)是最近报道的一类低髓鞘白 质 营养不良,其特征为婴儿期开始的眼球震颤, 步态共济失调,构音 障碍,伴或不伴痉挛[Steenweg et al 2012]。脑部MRI显示特征性的图案,伴有轻度的 T2- 加权的 额脑室周围白质、视 辐射,延髓,脑桥尾侧,皮层小脑白质的齿状核门,和齿状回周围白质的高强信 号。 一个典型的图案是在 内囊后肢T2- 加权图像中交替的高-低-高强度信号纹带。据认为是X连锁遗传; 但其致病性突变基因还没找到。
周围神经病变, 中央低髓鞘, Waardenburg, Hirschsprung (PCWH)是 由SOX10的 致病性变异体导致 [Inoue et al 1999, Inoue et al 2002]. 临床特征包括: 周围神经低髓鞘病变(导致感觉障碍和牵张反射 丧失); 低髓鞘白质营养不良( 导致早发性肌张力低 下,发育迟缓,眼球震颤,随着时间的推移发展到痉挛和小脑性共济失调); Waardenburg syndrome ( 表现为色素异常包括 虹膜异色、感觉神经的听力损失); 和 Hirschsprung 病。 常染色体显性遗传。
处理
初始诊断后的评估
为确定被诊断为聚合酶III-相关的白质营养不良个体的疾病程度和需要, 推荐以下措施:
-
儿科神经病学咨询
-
吞咽评估
-
理疗评估
-
职业治疗评估
-
神经心理评估
-
脑部MRI(若诊断时没做过)
-
牙科咨询
-
内分泌咨询
-
临床遗传咨询
征候处治
建议由多专业团队护理(care),包括儿科神经专家,临床遗传专家,理疗 师, 职能治疗师, 神经心理专家, 牙医, 内分泌专家和家庭医生。
表征如行动困难,厌食和癫痫为常规处理。
痉挛的处理包括去除刺激物,康复治 疗(例如,物理治疗,拉伸),口服药物(如巴氯芬),神经松解术,肉毒素注射、矫形外 科手术,和不太常用的鞘内注射巴氯芬泵植入。
多涎由多专业团队和 耳鼻喉科医师与 社工处理。处置依个人而定。可考 虑的治疗包括康复治疗 (比如口腔运动治疗, 行为治疗); 医药治疗 ( 比如格隆铵/胃 长宁,抗胆碱能药物,注射肉毒杆菌毒素);和手术(例如,对颌下腺导管移位或伴有或没有舌下 腺切除术的腮腺导管移 位)。
吞咽和因此而致的营养问题在某些个体需要肠切除术。
上学困难可能会发展比较缓慢,因为牵涉到认知的与运动的功能相比远没那么严重。 相反,由于行动困难使病人渐渐更为依赖他人的协助,日常活动倒可能在疾病早期成为问题。
若必要,口腔表征由牙医/矫形牙医处理 。
可以考虑建议激素替代疗法。
监测
至今还没有一个监测指南。建议以下措施:
-
定期评估: 每三到六个月,或如需要更频些,来处理脑白质营养不良的表征(痉挛, 多涎)
-
跟踪评估来处理内分泌异常。
研究中的治疗方法
搜 ClinicalTrials.gov 网站获取各种疾病和条件的临床研究的信息。註: 不一定有这个疾病的临床实验。
遗传咨询
遗传咨询是为个体或家庭提供遗传病的性质,遗传及涵义的信息之过程, 以帮助他们作出明智的,医学上的或个人的决定。以下部分探讨 遗传风险评估和用家族史及遗传检测来辨别家族成员的遗传状 态。这部分无意解决可能遇到的所有个人,文化,或伦理问题,或替代对遗传学专家的咨 询。— ED。
遗传方式
聚合酶III-相关的白质营养不良是常染色体隐性遗传。
携带者检测
若家系中致病性变异体已确认,就有可能检测出有风险的家庭成员中的携带者。
组织机构资源
GeneReviews人员为病人和其家庭选择了以下针对特定疾病或一般支持的组 织和/或注册机构。 但GeneReviews并不对其它机构提供的信息承担责任。可 点击这 里查看 挑选的标准。
-
Australian Leukodystrophy Support Group, Inc.Nerve Centre54 Railway RoadBlackburn Victoria 3130AustraliaPhone: 1800-141-400 (toll free); +61 3 98452831Fax: +61 3 95834379Email: mail@alds.org.au
-
European Leukodystrophy Association (ELA)2, rue Mi-les-VignesB.P. 61024Laxou Cedex 54521FrancePhone: 03833093 34Fax: 03833000 68Email: ela@ela-asso.com
-
Leukodystrophy Foundation1713, rue des ??pinettes-RougesQu??bec City Quebec G3G 2L2CanadaPhone: 418 806-2968Fax: 1 866 421-6846Email: info@leucofondation.com
-
United Leukodystrophy Foundation (ULF)224 North Second StreetSuite 2DeKalb IL 60115Phone: 800-728-5483 (toll-free); 815-748-3211Fax: 815-748-0844Email: office@ulf.org
-
Myelin Disorders Bioregistry ProjectEmail: myelindisorders@cnmc.org
分子遗传学
分子遗传学和OMIM表格中的信息可能与 GeneReview其它部分的有别: 表格可能涵盖更新的信息 —ED.
表 A
聚合酶III-相关的白质营养不良: 基因与数据库
表 B
OMIM 中的聚合酶III-相关的白质营养不良列表 (在 OMIM中浏览)
| 607694 | LEUKODYSTROPHY, HYPOMYELINATING, 7, WITH OR WITHOUT OLIGODONTIA AND/OR HYPOGONADOTROPIC HYPOGONADISM; HLD7 |
| 614258 | POLYMERASE III, RNA, SUBUNIT A; POLR3A |
| 614366 | POLYMERASE III, RNA, SUBUNIT B; POLR3B |
| 614381 | LEUKODYSTROPHY, HYPOMYELINATING, 8, WITH OR WITHOUT OLIGODONTIA AND/OR HYPOGONADOTROPIC HYPOGONADISM; HLD8 |
分子遗传病理
三类聚合酶(Pol I, II, and III) 负责转录DNA为RNA [Werner et al 2009, Cramer et al 2008].
Pol I, II, 和 III 有不同的靶DNA。POLR3A 和 POLR3B 是Pol III
最大的两个亚基,组成聚合酶III的催化中心。
-
Pol I 转录前体rRNA。 后者再被加工修饰为组成18S, 5.8S, 和 28S 核糖体亚基的大多数RNA.
-
Pol II 转录所有蛋白编码基因和很多非编码基因,包括大多数microRNAs (miRNAs).
-
Pol III 有多种核内的靶点并转录胞质中的外源DNA。
-
在核内,它转录所有tRNAs (转移 RNA), 7SL RNA (为蛋白插入细胞膜所需), 7SK, Alu, 和 B2 元件RNA(负责Pol II转录).
-
在一些miRNA的转录中可起作用, 但没象Pol II那样广泛 [Dieci et al 2007].
-
转录核糖体亚基5S 基因, 参与胞质和线粒体内的翻译 [Szymański et al 2003].
-
转录穹窿体RNA为穹窿体细 胞器 (负责mRNA从核到胞质检的转运).
-
POLR3A
基因结构. POLR3A 有31个外显子. 其详细的基因 和蛋白的信息概述, 见 表 A, 基因.
致病性变异体. 包括 错义突变, 无义突变, 和剪接位点变异体,缺失, 和插入 [Bernard et al 2011, Saitsu et al 2011, Potic et al 2012]. 见 表 2 (pdf).
还没有受累个体被发现携带有两个无功能变异体 , 这可被其为看家基因所解释, 提示部分残留的polIII功能对胚胎/胎儿存活是必须的。
正常基因产物. POLR3A编 码DNA指导的RNA聚合酶III亚基A,由1390氨基酸组成。 POLR3A, Pol III的17个亚基中最大的, 与POLR3B组成聚合酶的催化中心。
异常基因产物. 致病性变异体在POLR3A蛋白功能区的图谱提示它们能直接干扰DNA结合, 修饰酶催化裂隙的结构, 改变POLR3A/POLR3B相互作用, 和干扰POLR3A与其它Pol III亚基的相互作用[Bernard et al 2011].
有人假设POLR3A的致病性变异体是导致了PolIII复合体和少 许程度上PolIII大分子不能最优化的组装。实际上, 对一位POLR3A致病性变异体鉴定出了 的,4H 综合征患者的成纤维和脑组织的western blot 研究显示了统计意义上POLR3A 水平显著减少,脑白质比皮质减少尤为显著[Bernard et al 2011].
POLR3B
基因结构. POLR3B由28个外显子组成. 其详细的基因和蛋白的信息概述, 见 表 A, 基因.
致病性变异体. 包括 错义突变, 无义突变, 和剪接位点变异体,缺失 [Saitsu et al 2011, Tétreault et al 2011]. 见 表 3 (pdf).
还没有受累个体被发现携带有两个无功能变异体 , 这可被其为看家基因所解释, 提示部分残留的polIII功能对胚胎/胎儿存活是必须的。
正常基因产物. POLR3B编码DNA指导的RNA聚合酶III亚基B,由 1133个氨基酸组成。 POLR3B, Pol III的17个亚基中第二大的, 与POLR3A组成聚合酶的催化中心。
异常基因产物. 致病性变异体在POLR3A蛋白功能区的图谱提示它们能直接干扰DNA结合, 修饰催化裂隙的结构, 改变POLR3A/POLR3B相互作用, 和影响POLR3B与其它Pol III亚基的相互作用[Tétreault et al 2011].
参考书目
引文索引
-
Atrouni S, Darazé A, Tamraz J, Cassia A, Caillaud C, Mégarbané A. Leukodystrophy associated with oligodontia in a large inbred family: fortuitous association or new entity? Am J Med Genet A. 2003;118A:76–81. [PubMed: 12605447]
-
Bekiesinska-Figatowska M, Mierzewska H, Kuczynska-Zardzewialy A, Szczepanik E, Obersztyn E. Hypomyelination, hypogonadotropic hypogonadism, hypodontia - First Polish patient. Brain Dev. 2010;32:574–8. [PubMed: 19700253]
-
Benini R, Saint-Martin C, Shevell MI, Bernard G. Abnormal myelination in ring chromosome 18 syndrome. J Child Neurol. 2012;27:1042–7. [PubMed: 22290857]
-
Bernard G, Chouery E, Putorti ML, Tétreault M, Takanohashi A, Carosso G, Clément I, Boespflug-Tanguy O, Rodriguez D, Delague V, Abou Ghoch J, Jalkh N, Dorboz I, Fribourg S, Teichmann M, Megarbane A, Schiffmann R, Vanderver A, Brais B. Mutations of POLR3A encoding a catalytic subunit of RNA polymerase Pol III cause a recessive hypomyelinating leukodystrophy. Am J Hum Genet. 2011;89:415–23. [PMC free article: PMC3169829 ] [PubMed: 21855841]
-
Bernard G, Thiffault I, Tétreault M, Putorti ML, Bouchard I, Sylvain M, Melancon S, Laframboise R, Langevin P, Bouchard JP, Vanasse M, Vanderver A, Sebire G, Brais B. Tremor-ataxia with central hypomyelination (TACH) leukodystrophy maps to chromosome 10q22.3-10q23.31. Neurogenetics. 2010;11:457–64. [PMC free article: PMC4147760 ] [PubMed: 20640464]
-
Chouery E, Delague V, Jalkh N, Salem N, Kfoury J, Rodriguez D, Chabrol B, Boespflug-Tanguy O, Lévy N, Serre JL, Mégarbané A. A whole-genome scan in a large family with leukodystrophy and oligodontia reveals linkage to 10q22. Neurogenetics. 2011;12:73–8. [PubMed: 20721593]
-
Cramer P, Armache KJ, Baumli S, Benkert S, Brueckner F, Buchen C, Damsma GE, Dengl S, Geiger SR, Jasiak AJ, Jawhari A, Jennebach S, Kamenski T, Kettenberger H, Kuhn CD, Lehmann E, Leike K, Sydow JF, Vannini A. Structure of eukaryotic RNA polymerases. Annu Rev Biophys. 2008;37:337–52. [PubMed: 18573085]
-
Dieci G, Fiorino G, Castelnuovo M, Teichmann M, Pagano A. The expanding RNA polymerase III transcriptome. Trends Genet. 2007;23:614–22. [PubMed: 17977614]
-
Durand P, Borrone C, Della CG. Fucosidosis. J Pediatr. 1969;75:665–74. [PubMed: 4241464]
-
Giglia-Mari G, Coin F, Ranish JA, Hoogstraten D, Theil A, Wijgers N, Jaspers NG, Raams A, Argentini M, van der Spek PJ, Botta E, Stefanini M, Egly JM, Aebersold R, Hoeijmakers JH, Vermeulen W. A new, tenth subunit of TFIIH is responsible for the DNA repair syndrome trichothiodystrophy group A. Nat Genet. 2004;36:714–9. [PubMed: 15220921]
-
Inoue K, Shilo K, Boerkoel CF, Crowe C, Sawady J, Lupski JR, Agamanolis DP. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Ann Neurol. 2002;52:836–42. [PubMed: 12447940]
-
Inoue K, Tanabe Y, Lupski JR. Myelin deficiencies in both the central and the peripheral nervous systems associated with a SOX10 mutation. Ann Neurol. 1999;46:313–8. [PubMed: 10482261]
-
Kline AD, White ME, Wapner R, Rojas K, Biesecker LG, Kamholz J, Zackai EH, Muenke M, Scott CI Jr, Overhauser J. Molecular analysis of the 18q- syndrome--and correlation with phenotype. Am J Hum Genet. 1993;52:895–906. [PMC free article: PMC1682039 ] [PubMed: 8488839]
-
Kousseff BG, Beratis NG, Strauss L, Brill PW, Rosenfield RE, Kaplan B, Hirschhorn K. Fucosidosis type 2. Pediatrics. 1976;57:205–13. [PubMed: 814528]
-
Kraemer KH, Patronas NJ, Schiffmann R, Brooks BP, Tamura D, DiGiovanna JJ. Xeroderma pigmentosum, trichothiodystrophy and Cockayne syndrome: a complex genotype-phenotype relationship. Neuroscience. 2007;145:1388–96. [PMC free article: PMC2288663 ] [PubMed: 17276014]
-
Lancaster JL, Cody JD, Andrews T, Hardies LJ, Hale DE, Fox PT. Myelination in children with partial deletions of chromosome 18q. AJNR Am J Neuroradiol. 2005;26:447–54. [PubMed: 15760848]
-
Linnankivi T, Tienari P, Somer M, K?hk?nen M, L?nnqvist T, Valanne L, Pihko H. 18q deletions: clinical, molecular, and brain MRI findings of 14 individuals. Am J Med Genet A. 2006;140:331–9. [PubMed: 16419126]
-
Miller G, Mowrey PN, Hopper KD, Frankel CA, Ladda RL. Neurologic manifestations in 18q- syndrome. Am J Med Genet. 1990;37:128–32. [PubMed: 1700607]
-
Orcesi S, Tonduti D, Uggetti C, Larizza D, Fazzi E, Balottin U. New case of 4H syndrome and a review of the literature. Pediatr Neurol. 2010;42:359–64. [PubMed: 20399393]
-
Potic A, Brais B, Choquet K, Schiffmann R, Bernard G. 4H syndrome with late-onset growth hormone deficiency caused by POLR3A mutations. Arch Neurol. 2012;69:920–3. [PubMed: 22451160]
-
Saitsu H, Osaka H, Sasaki M, Takanashi JI, Hamada K, Yamashita A, Shibayama H, Shiina M, Kondo Y, Nishiyama K, Tsurusaki Y, Miyake N, Doi H, Ogata K, Inoue K, Matsumoto N. Mutations in POLR3A and POLR3B encoding RNA polymerase III subunits cause an autosomal-recessive hypomyelinating leukoencephalopathy. Am J Hum Genet. 2011;89:644–51. [PMC free article: PMC3213392 ] [PubMed: 22036171]
-
Sasaki M, Takanashi J, Tada H, Sakuma H, Furushima W, Sato N. Diffuse cerebral hypomyelination with cerebellar atrophy and hypoplasia of the corpus callosum. Brain Dev. 2009;31:582–7. [PubMed: 18851904]
-
Sato I, Onuma A, Goto N, Sakai F, Fujiwara I, Uematsu M, Osaka H, Okahashi S, Nonaka I, Tanaka S, Haginoya K. A case with central and peripheral hypomyelination with hypogonadotropic hypogonadism and hypodontia (4H syndrome) plus cataract. J Neurol Sci. 2011;300:179–81. [PubMed: 20884016]
-
Schiffmann R, van der Knaap MS. Invited article: an MRI-based approach to the diagnosis of white matter disorders. Neurology. 2009;72:750–9. [PMC free article: PMC2677542 ] [PubMed: 19237705]
-
Steenweg ME, Vanderver A, Blaser S, Bizzi A, de Koning TJ, Mancini GM, van Wieringen WN, Barkhof F, Wolf NI, van der Knaap MS. Magnetic resonance imaging pattern recognition in hypomyelinating disorders. Brain. 2010;133:2971–82. [PMC free article: PMC3589901 ] [PubMed: 20881161]
-
Steenweg ME, Wolf NI, Schieving JH, Fawzi Elsaid M, Friederich RL, Ostergaard JR, Barkhof F, Pouwels PJ, van der Knaap MS. Novel hypomyelinating leukoencephalopathy affecting early myelinating structures. Arch Neurol. 2012;69:125–8. [PubMed: 22232354]
-
Szymański M, Barciszewska MZ, Erdmann VA, Barciszewski J. 5 S rRNA: structure and interactions. Biochem J. 2003;371:641–51. [PMC free article: PMC1223345 ] [PubMed: 12564956]
-
Takayama K, Danks DM, Salazar EP, Cleaver JE, Weber CA. DNA repair characteristics and mutations in the ERCC2 DNA repair and transcription gene in a trichothiodystrophy patient. Hum Mutat. 1997;9:519–25. [PubMed: 9195225]
-
Tétreault M, Choquet K, Orcesi S, Tonduti D, Balottin U, Teichmann M, Fribourg S, Schiffmann R, Brais B, Vanderver A, Bernard G. Recessive mutations in POLR3B, encoding the second largest subunit of Pol III, cause a rare hypomyelinating leukodystrophy. Am J Hum Genet. 2011;89:652–5. [PMC free article: PMC3213403 ] [PubMed: 22036172]
-
Tétreault M, Putorti ML, Thiffault I, Sylvain M, Venderver A, Schiffmann R, Brais B, Bernard G. TACH leukodystrophy: locus refinement to chromosome 10q22.3-23.1. Can J Neurol Sci. 2012;39:122–3. [PubMed: 22384513]
-
Timmons M, Tsokos M, Asab MA, Seminara SB, Zirzow GC, Kaneski CR, Heiss JD, van der Knaap MS, Vanier MT, Schiffmann R, Wong K. Peripheral and central hypomyelination with hypogonadotropic hypogonadism and hypodontia. Neurology. 2006;67:2066–9. [PMC free article: PMC1950601 ] [PubMed: 17159124]
-
van der Knaap MS, Linnankivi T, Paetau A, Feigenbaum A, Wakusawa K, Haginoya K, K?hler W, Henneke M, Dinopoulos A, Grattan-Smith P, Brockmann K, Schiffmann R, Blaser S. Hypomyelination with atrophy of the basal ganglia and cerebellum: follow-up and pathology. Neurology. 2007;69:166–71. [PubMed: 17620549]
-
van der Knaap MS, Naidu S, Pouwels PJ, Bonavita S, van Coster R, Lagae L, Sperner J, Surtees R, Schiffmann R, Valk J. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. AJNR Am J Neuroradiol. 2002;23:1466–74. [PubMed: 12372733]
-
Vázquez-López M, Ruiz-Martín Y, de Castro-Castro P, Garzo-Fernández C, Martín-del Valle F. Central hypomyelination, hypogonadotrophic hypogonadism and hypodontia: a new leukodystrophy. Rev Neurol. 2008;47:204–8. Márquez-de la Plata. [PubMed: 18671210]
-
Werner M, Thuriaux P, Soutourina J. Structure-function analysis of RNA polymerases I and III. Curr Opin Struct Biol. 2009;19:740–5. [PubMed: 19896367]
-
Wolf NI, Harting I, Boltshauser E, Wiegand G, Koch MJ, Schmitt-Mechelke T, Martin E, Zschocke J, Uhlenberg B, Hoffmann GF, Weber L, Ebinger F, Rating D. Leukoencephalopathy with ataxia, hypodontia, and hypomyelination. Neurology. 2005;64:1461–4. [PubMed: 15851747]
-
Wolf NI, Harting I, Innes AM, Patzer S, Zeitler P, Schneider A, Wolff A, Baier K, Zschocke J, Ebinger F, Boltshauser E, Rating D. Ataxia, delayed dentition and hypomyelination: a novel leukoencephalopathy. Neuropediatrics. 2007;38:64–70. [PubMed: 17712733]
-
Wolff A, Koch MJ, Benzinger S, van Waes H, Wolf NI, Boltshauser E, Luder HU. Rare dental peculiarities associated with the hypomyelinating leukoencephalopathy 4H syndrome/ADDH. Pediatr Dent. 2010;32:386–92. [PubMed: 21070704]
建议阅读
-
Hu P, Wu S, Sun Y, Yuan CC, Kobayashi R, Myers MP, Hernandez N. Characterization of human RNA polymerase III identifies orthologues for Saccharomyces cerevisiae RNA polymerase III subunits. Mol Cell Biol. 2002;22:8044–55. [PMC free article: PMC134740 ] [PubMed: 12391170]
本章註解
致谢
Dr Bernard wishes to thank the “Fondation sur les Leucodystrophies,” the “Fondation Go,” the European Leukodystrophy Association, and the Montreal Children’s Hospital and Montreal University Health Center Research Institutes for financing her research projects on leukodystrophies. She also wishes to thank the Montreal Children’s Hospital Foundation, the MSSA (Medical Staff Service Association), the MCHAN (Montreal Children’s Hospital Associates in Neurology) and FRSQ (Fonds de Recherche en Santé du Québec) for her clinician-scientist salary awards. She also wishes to thank Dr Bernard Brais for his mentorship throughout this project. Dr Vanderver wishes to thank the Intramural Research Program of the National Human Genome Research Institute and the Myelin Disorders Bioregistry Project. Drs Bernard and Vanderver wish to thank all patients and their families as well as all the collaborators who were involved in the 聚合酶III-相关的白质营养不良 project.
改编记录
-
2 August 2012 (me) Review posted live
-
1 March 2012 (av) Original submission
- 此译文为2012版,在近期将被 2017五月版取代 - 译者注,
2017,9,23。