简介
临床特征 具有严重生物素酶缺乏症的幼儿通常表现出神经异常,包括癫痫发作,肌张力减退,共济失调,发育迟缓,视力问题, 听力丧失和皮肤异常(例如,脱发,皮疹,念珠菌病)。 年龄较大的儿童和青少年通常表现出运动肢体无力,痉挛性轻瘫和视力下降。一旦出现视力问题,听力损失和发育迟缓,即使使用生物素治疗,它们通常也是不可逆转的。部分生物素酶缺乏的个体可能有张力减退,皮疹和脱发,特别是在有外界压力期间。
诊断/检测 生物素酶缺乏的诊断建立在先证者中,其新生儿筛查或生化结果表明多种羧化酶缺乏基于检测血清/血浆中缺乏的生物素酶活性或分子遗传学检测鉴定BTD中双等位基因的致病变异。
管理 表现的治疗:当每天用5-10mg口服生物素治疗时,所有具有严重生物素酶缺乏症的症状儿童都会得到改善。所有具有严重生物素酶缺乏症的个体,即使是那些具有一些残留酶活性的个体,都应该终身用生物素治疗。有视力问题的儿童可能会受益于视力辅助;有听力损失的人通常会受益于助听器或人工耳蜗,以及那些因适当干预而有发育缺陷的人。
预防主要表现:通过新生儿筛查确定的生物素酶缺乏症儿童如果早期生物素治疗并持续终生应保持无症状。
监测:年度视力和听力评估,体格检查以及代谢专家的定期评估。
需要避免的药物/情况:生鸡蛋因为含有抗生物素蛋白,可以结合生物素并降低维生素的生物利用度。
评估有风险的亲属:对先证者的无症状同胞进行检测,确保可以及时制定受累的同胞的生物素治疗。
遗传咨询 生物素酶缺乏症以常染色体隐性遗传方式遗传。每次怀孕时,患有一个受累的孩子的夫妇,他们的孩子有25%的机会患病,50%的几率为 携带者,并且有25%的机会不患病也不是携带者。如果家族中的致病变异已知,则对有风险的家庭成员进行携带检测以及对风险增加的怀孕进行产前检测。
诊断
关于生物素酶缺乏症的临床问题和常见问题已在相关的综述中得到解决[Wolf 2010].
支持性证据
对于新生儿筛查结果阳性,未经治疗的婴儿,以下临床和/或实验室检查结果可能对生物素酶缺乏症的诊断有提示作用 [[Wolf 2012]:
阳性新生儿筛查(NBS)结果 在美国几乎100%具有生物素酶缺乏或部分生物素酶缺乏的婴儿可以通过新生儿筛查检测到(参见National Newborn Screening Status Report)。
新生儿筛查利用从足跟刺中获得的少量血液进行生物素酶活性的比色测试:
- 在充分干燥之前,早产儿和置于塑料中的样品中可能出现假阳性测试结果。
- 初始筛查试验异常的婴儿应保证血清/血浆中生物素酶活性的测量。
临床发现 未经治疗的生物素酶缺乏症的儿童或成人通常表现出一种或多种以下非特异性特征(在许多其他遗传性代谢紊乱中也观察到):
- 癫痫发作
- 肌张力低下
- 呼吸系统疾病包括过度通气,喉部喘鸣和呼吸暂停
- 发育迟缓
- 听力损失
- 视力问题,如视神经萎缩
更具体的生物素酶缺乏症的特征包括以下内容:
- 湿疹皮疹
- 脱发
- 结膜炎
- 念珠菌
- 共济失调
年龄较大的儿童和青少年可能表现出四肢无力,轻瘫和盲点。 有些人表现出脊髓病的症状,并且在生物素酶缺乏被正确诊断之前,最初被错误地诊断并治疗为患有另一种疾病[Wolf 2015]。
患有部分生物素酶缺乏症的儿童或成人可能表现出任何上述症状和体征,但表现为轻微,仅在患者受到压力时发生,例如长期感染。
初步实验室结果 以下发现提示生物素酶缺乏症 :
- 代谢性酮症酸中毒
- 有机酸尿(通常有多种羧化酶缺乏症中常见的代谢物;然而,3-羟基异戊酸可能是存在的唯一代谢物)。 注意:即使对于有症状的生物素酶缺乏症患者,尿中有机酸也可能是正常的。
- 高血氨症
建立诊断
生物素酶缺乏症的诊断是在先证者中确定的,其新生儿筛查或生化结果表明多种羧化酶缺乏基于以下:
- 检测血清/血浆中缺乏的生物素酶活性,要么
血清中的生物素酶活性 美国医学遗传学实验室质量保证委员会工作组制定了生物素酶缺乏症诊断技术标准和指南 [Cowan et al 2010] (full text).
- 严重的生物素酶缺乏,<10%意味着正常的血清生物素酶活性
- 部分生物素酶缺乏:平均正常血清生物素酶活性的10%-30%
注意:(1)通过适当的控制,生化检测对确认诊断具有决定性作用。 重要的是,正常无关的对照样品和来自亲本的样品伴随来自先证者的血清/血浆样品到诊断实验室以准确解释酶结果[Neto et al 2004]。 (2)日益增加的酶降解问题(假阳性)几乎可以肯定是在运往商业实验室或某些实验室之前样品储存不充分的结果[Wolf 2003]。
分子遗传学测试通过单基因测试进行 首先进行BTD的序列分析, 如果仅发现一种 致病性变异,则进行基因靶向deletion/duplication analysis 分析。
Table 1.
用于生物素酶缺乏症的分子遗传学检测
| 基因 1 | 测试方法 | Proportion of Probands with Pathogenic Variants 2 Detectable by This Method |
|---|---|---|
| BTD | Sequence analysis 3 | ~99% 4 |
| Gene-targeted deletion/duplication analysis 5 | See footnote 6 |
- 1.
染色体 位点和蛋白质见 Table A. Genes and Databases . 等位基因变异见 Molecular Genetics
- 2.
有关在该 基因中检测到的等位基因变异的信息,请参见 Molecular Genetics .
- 3.
- 4.
几乎所有具有部分生物素酶缺乏的个体都具有 致病性变异 p.Asp444His在BTD的一个 等位基因中与其他等位基因的严重缺陷的致病变异组合 [Swango et al 1998].
- 5.
靶向 deletion/duplication analysis 鉴定基因内缺失和扩增 。 可以使用的各种方法包括:quantitative PCR,长程PCR,多重连接依赖性探针扩增(MLPA)和包括该基因/染色体片段的染色体芯片(CMA)和单基因靶向微阵列鉴定单个外显子的缺失和扩增
- 6.
在 受累的个体中已经报道了两个大的BTD缺失[Senanayake et al 2015, Wolf 2016].
测试特性 有关测试特征的信息,包括 敏感性和特异性,请参见Clinical Utility Gene Card [Küry et al 2012]。
临床特征
临床表现
具有生物素酶缺乏症的个体在出现症状之前被诊断出来(例如,通过 新生儿筛查)并且用生物素治疗具有正常发育[Möslinger et al 2001, Weber et al 2004](另见管理,Prevention of Primary Manifestations )。神经系统问题仅发生在生物素治疗前出现反复症状和代谢受损的患者中。
严重的生物素酶缺乏症 发病初期,未经治疗的严重生物素酶缺乏症(<10%意味着正常血清生物素酶活性)的症状通常出现在1周至10年之间,平均年龄为3个半月[Wolf et al 1985b]。
一些患有生物素酶缺乏症的儿童仅有一种表现,而其他儿童表现出多种神经和皮肤发现。
未经治疗的,严重的生物素酶缺乏的个体中最常见的神经学特征是癫痫发作和肌张力减退[Wolf et al 1983a, Wolf et al 1985b, Wastell et al 1988, Wolf 1995, Wolf 2011]。癫痫发作通常是肌阵挛,但可能是大发作和局部发作;有些孩子患有婴儿痉挛[Salbert et al 1993b]。一些未经治疗的儿童表现出脊髓受累,其特征为进行性痉挛性麻痹和脊髓病[Chedrawi et al 2008]。年龄较大的受累的儿童常有共济失调和发育迟缓。
许多患有生物素酶缺乏症的有症状的儿童在脑MRI或CT上表现出多种中枢神经系统异常[Wolf et al 1983b, Wastell et al 1988, Lott et al 1993, Salbert et al 1993b, Grünewald et al 2004]。生物素处理后这些发现可能会改善或变得正常。
感觉神经性听力损失和眼睛问题(例如,视神经萎缩)也已在未治疗的儿童中描述[Wolf et al 1983b, Taitz et al 1985, Salbert et al 1993a, Weber et al 2004]。大约76%的未经治疗的有症状的儿童患有严重的生物素酶缺乏症,其感觉神经性听力损失通常无法消退或改善,但在生物素治疗中仍然保持稳定[Wolf et al 2002]。
皮肤表现包括皮疹,脱发和由免疫功能障碍引起的反复性病毒或真菌感染。
可能发生呼吸道疾病,包括过度通气,喉部喘鸣和呼吸暂停。
最初认为由婴儿猝死综合症引起的一例死亡后来归因于生物素酶缺乏[Burton et al 1987]。
发病晚 许多患有严重生物素酶缺乏症的儿童直到青春期才出现症状,当时他们因进行性视神经病变和痉挛性下肢瘫痪而突然失明[Ramaekers et al 1992, Lott et al 1993, Ramaekers et al 1993]。经过几个月的生物素治疗后,眼部发现得到了解决,痉挛性下肢瘫痪得到了改善。在其他缺乏酶的个体中,青春期早期出现麻痹和眼部问题 [Tokatli et al 1997, Wolf et al 1998, Wolf 2015]。
部分生物素酶缺乏症 具有部分生物素酶缺乏症(平均正常血清生物素酶活性的10%-30%)的个体可能仅在受压时(例如在感染期间)出现症状。
一名患有部分生物素酶缺乏但未接受生物素治疗的儿童在大约6个月的胃肠炎发作期间表现出肌张力减退,皮疹和脱发。当用生物素处理时,症状得到解决。
基因型 - 表型相关性
基因型/表型相关性尚未确定。 缺失,插入或nonsense 变异通常导致完全不存在生物素酶活性,而错义变异可能或可能不会导致生物素酶活性的完全丧失。 那些没有所有生物素酶活性的人可能会增加早期症状发作的风险。
尽管基因型-表型相关性尚未确定,但在一项研究中,具有无效 变异的严重生物素酶缺乏症状的儿童比具有 错义变异的儿童更容易发生听力损失,即使未经过一段时间的治疗[Sivri et al 2007]。
某些基因型与完全生物素酶缺乏症和其他部分生物素酶缺乏症相关:
严重的生物素酶缺乏症(<10%意味着正常的血清生物素酶活性:
- 一些患有严重生物素酶缺乏症的成年人从未出现过症状且从未接受过治疗[Wolf et al 1997],而一些具有相同致病性变异的儿童则有症状。 因此,据推测,一些患有严重生物素酶缺乏症的儿童如果不及时治疗可能表现出轻微或无症状。 尽管如此,建议对这些儿童进行治疗[Möslinger et al 2003]。
部分生物素酶缺乏症(平均正常血清生物素酶活性的10%-30%)
杂合子
外显率
几乎所有患有严重生物素酶缺乏症的儿童都会出现症状,如果不治疗,就有可能出现症状。
一些报告描述了具有严重生物素酶缺乏症的成年人,他们的后代也具有由新生儿筛查确定的严重的生物素酶缺乏,但他们从未出现过症状[Wolf et al 1997, Baykal et al 2005]。 此外,有症状的儿童的几个有缺乏酶的同胞显然从未表现出症状。 如果受到压力,这些个体可能会出现症状,例如长期感染。
命名法
严重和部分生物素酶缺乏症是这种疾病的公认术语。
具有部分生物素酶缺乏的个体先前被描述为具有迟发性或幼年型多重或组合的羧化酶缺乏症。
不应将生物素酶缺乏症与全羧化酶合成酶缺乏症(参见 Differential Diagnosis)混淆,之前称其为早发型或婴儿型多重或组合羧化酶缺乏症。
流行
根据世界范围内生物素酶缺乏筛查结果[Wolf 1991],该疾病的发病率为:
- 137,401人中有一人患有严重的生物素酶缺乏症;
- 109,921人中有一个部分生物素酶缺乏;
- 61,067人中的一个是严重和部分生物素酶缺乏的综合发生。
在具有高 近亲婚配的人群中,生物素酶缺乏症的发生率通常较高(例如,土耳其,沙特阿拉伯)。
西班牙裔人群的发病率似乎有所增加[Cowan et al 2012],而非洲裔美国人群的发病率可能较低。
一般人口中的携带频率约为1:120。
遗传相关(等位)疾病
除了在本GeneReview中讨论的表型之外,没有已知的表型与BTD中的致病变异相关.
鉴别诊断
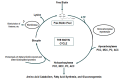
在遗传性代谢疾病中经常观察到临床特征,包括伴有代谢性酮酸性酸中毒或轻度高氨血症的呕吐,张力减退和癫痫发作。 具有生物素酶缺乏症的个体可能表现出在正确鉴定之前被误诊为其他疾病(例如, 孤立的羧化酶缺乏症)的临床特征 [Suormala et al 1985, Wolf & Heard 1989]。 在营养生物素缺乏,全羧化酶合成酶缺乏,缺锌或必需脂肪酸缺乏的儿童中也可发生生物素酶缺乏(例如,皮疹,脱发)更具特征的其他症状, 见Figure 1。
生物素缺乏症 生物素缺乏症通常可以通过饮食史来诊断。 具有生物素缺乏的个体可能具有含有生鸡蛋的饮食或者没有生物素补充的延长的肠胃外过度营养。
低血清生物素浓度可用于区分生物素和生物素酶缺乏与全羧化酶合成酶缺乏症; 然而,重要的是要知道用于确定生物素浓度的方法,因为只有区分生物素与生物素或结合的生物素的方法才能产生游离生物素浓度的可靠估计。
孤立的羧化酶缺乏症 尿液有机酸分析可用于区分孤立的羧化酶缺陷与生物素酶缺乏症和全羧化酶合成酶缺乏症中发生的多种羧化酶缺陷:
- 除β-羟基异戊酸外,尿酸乳酸,柠檬酸甲酯和β-羟基丙酸盐浓度升高也表明存在多种羧化酶缺乏症,包括上述疾病和propionic acidemia 和 pyruvate carboxylase deficiency.
多种羧化酶缺陷是生物素反应性的,而 孤立的羧化酶缺乏不是。生物素试验可用于区分这些疾病。
通过证明外周血白细胞中三种线粒体羧化酶之一(在生物素处理之前)或在含有低生物素的培养基中生长的培养的成纤维细胞以及其他两种羧化酶的正常活性,可以诊断分离的羧化酶缺乏症。
全羧化酶合成酶缺乏症(OMIM 253270) 生物素酶缺乏和全羧化酶合成酶缺乏的特征在于在生物素处理之前外周血白细胞中三种线粒体羧化酶的活性缺乏。在这两种疾病中,这些活性在生物素处理后增加至接近正常或正常。
生物素酶缺乏症和全羧化酶合成酶缺乏症的症状相似,临床区分通常很困难。
症状发作的年龄可用于区分全羧化酶合成酶缺乏症和生物素酶缺乏症。全羧化酶合成酶缺乏症通常在3个月前出现症状,而生物素酶缺乏症通常在3个月后出现;然而,这两种疾病都有例外。
生物素酶缺乏和全羧化酶合成酶缺乏的有机酸异常是相似的,并且可以报道为与多种羧化酶缺乏一致。然而,正在纳入许多 新生儿筛查计划的串联质谱方法应该鉴定与多种羧化酶缺乏一致的代谢物。因为大多数患有全羧化酶合成酶缺乏症的儿童在新生儿期排泄这些代谢物,所以应该使用该技术识别该病症。
需要确定的酶测定来区分这两种疾病 :
- 具有全羧化酶合成酶缺陷的个体的血清中的生物素酶活性正常; 因此,新生儿筛查中使用的生物素酶活性的酶促测定对生物素酶缺乏具有特异性,并且不能识别具有全羧化酶合成酶缺陷的儿童。
- 具有全羧化酶合成酶缺陷的个体在成纤维细胞的提取物中具有三种线粒体羧化酶的缺乏活性,所述成纤维细胞的培养物在仅含有由胎牛血清(低生物素)贡献的生物素的培养基中孵育,而具有生物素酶缺乏的个体在成纤维细胞中具有正常的羧化酶活性。 当在补充有生物素(高生物素)的培养基中培养时,具有全羧化酶合成酶缺陷的个体的成纤维细胞中羧化酶的活性变得接近正常。
感觉神经性听力损失(见Deafness and Hereditary Hearing Loss Overview)。 感觉神经性听力损失有很多原因。 通过测定血清中的生物素酶活性,可以排除生物素酶缺乏症的原因。 该测试应专门针对具有与生物素酶缺乏一致的其他临床特征的听力损失儿童进行。
处理
初步诊断后的评估
为了确定被诊断患有生物素酶缺乏症的有症状个体的疾病和需求程度,建议进行以下评估:
- 癫痫病史,平衡问题,喂养问题,呼吸问题,头发脱落,真菌感染,皮疹,结膜炎
- 对张力减退,共济失调,眼部发现,如视神经萎缩,湿疹性皮疹,脱发,结膜炎,呼吸异常如喘鸣,鹅口疮和/或念珠菌病的体格检查
- 评估精神运动缺陷
- 感觉神经性听力损失的评估
- 眼科检查
- 鉴定由免疫功能障碍引起的复发性病毒或真菌感染风险增加导致的细胞免疫异常
- 咨询代谢专家或临床遗传学家
为确定新生儿筛查后诊断为生物素酶缺乏症的婴儿或儿童的疾病和需求程度,建议进行以下评估:
- 神经系统检查结果(如肌张力减退,共济失调),眼部检查结果(如结膜炎),皮肤发现(湿疹,脱发),呼吸异常(如喘鸣)及免疫功能紊乱引起的真菌感染(鹅口疮和/或念珠菌病)的体格检查)。
- 评估精神运动缺陷
- 感觉神经性听力损失的评估
- 眼科检查(用于寻找视神经萎缩)
- 咨询代谢专家或临床遗传学家
治疗表现
虽然 新生儿筛查 几乎完全确定了美国和许多其他国家的生物素酶缺乏儿童,但偶尔会有一个未经筛查或被误认为在新生儿筛查中具有正常生物素酶活性的儿童会出现临床症状。这些儿童可能会代谢受损并需要补水,偶尔会出现碳酸氢盐酸中毒,以及高氨血症。一旦认识到孩子患有多种羧化酶缺乏症,给予生物素 - 或含有生物素的多种维生素“鸡尾酒” - 可以在数小时到数天内迅速解决代谢紊乱并改善许多临床症状。
符合生物素治疗(参见 Prevention of Primary Manifestations)可改善有症状个体的症状。
视神经萎缩,听力丧失或发育迟缓等一些特征可能不可逆;它们应该通过眼科评估和干预,助听器或人工耳蜗植入以及针对发育缺陷的适当干预来解决。
预防主要表现
所有具有严重生物素酶缺乏症(<10%意味着正常酶活性)的个体,即使是那些具有一些残留生物素酶活性的个体,都应该用生物素进行处理,而不依赖于它们的基因型 [Wolf 2003]。注意:尽管Möslinger et al [2003]指出,生物素酶活性超过1%至10%的儿童可能不需要治疗,但生物素酶活性为1%至10%的儿童完全丧失酶活性而可能会出现症状 [Wolf 2002]。因此,强烈建议所有患有严重生物素酶缺乏症的儿童,无论残留的生物素酶活性如何,均应使用生物素进行治疗。
注意:由于生物素酶缺乏症的 基因型/表型相关性尚未确定,因此有关治疗的决定应基于酶活性的结果而不是分子遗传学检测。
与结合形式相反,通过补充游离形式的口服生物素来治疗生物素酶缺乏症。由新生儿筛查鉴定的具有生物素酶缺乏的儿童将保持无症状且符合生物素治疗。
所有患有生物素酶缺乏症的症状儿童在每天用5-10mg口服生物素治疗后有所改善。
生物素通常以片剂或胶囊的形式分配(大部分是填充剂:生物素的量相对于填充剂的量是微小的)。为了将生物素施用于婴儿或幼儿,可以将片剂压碎或将胶囊的内容物与母乳或配方混合在勺子,药物分配器或注射器中。请注意,不应将片剂或胶囊的内容物放入瓶中,因为混合物会粘在瓶子上和/或不能通过乳头,从而导致剂量不一致。
尽管偶尔将生物素分配为溶液或糖浆,但不建议使用这些液体制剂,因为混合物(即悬浮液)倾向于沉淀(特别是在冷藏时)并在储存时生长细菌。液体制剂通常不能提供一致的剂量,不应加入瓶中的牛奶中。
生物素处理后生化异常和癫痫发作迅速消退,随后皮肤异常改善。患有脱发的儿童的头发生长会在数周至数月内恢复。视神经萎缩和听力丧失可能对治疗有抵抗,特别是如果在发病和开始治疗之间已经过了很长时间。一些接受治疗的儿童迅速取得了发育进展,而其他儿童继续表现出延迟。
关于未使用生物素治疗的部分生物素酶缺乏症患儿的症状,仅有少数报道。由于对生物素没有已知的毒性,部分缺乏的儿童通常每天用1-10mg口服生物素治疗。
生物素疗法是终身的。药理学剂量的生物素没有已知的不良副作用。事实上,主要问题是缺乏治疗或不遵守处方治疗。
需要更多的数据来确定生物素的剂量,这对于患有严重或部分生物素酶缺乏的大龄儿童是必需的,但基本上所有儿童都能耐受10毫克/天的口服生物素而没有副作用。有趣的是,两名患有严重生物素酶缺乏症的女孩在青春期出现脱发,随着生物素剂量从每天10毫克增加到每天15或20毫克而消退。
不需要蛋白质限制饮食。
监控
适用于所有患有生物素酶缺乏症的儿童:
- 对缺陷严重的患者进行年度眼科检查和听力检查,对于部分缺乏患者,每两年进行一次眼科检查和听觉检查
- 定期与初级保健医生预约或根据需要预约
- 临床遗传学家或代谢专家对严重缺陷者进行年度评估,对于部分缺乏者每两年评估一次。
- 有遗留临床问题的症状性儿童应由相应的亚专业专家指导 :
- 如果使用生物素治疗恢复症状,评估尿中有机酸(最常见的是不遵守医嘱的结果)
注意:除了确定治疗依从性外,测量血液或尿液中的生物素浓度是没有用的
要避免的药物/情况
应避免生鸡蛋,因为它们含有抗生物素蛋白,一种结合生物素的白蛋白,从而降低其生物利用度。 (彻底煮熟的鸡蛋没有问题,因为加热使抗生物素蛋白失活,使其无法结合生物素。)
风险亲属的评估
具有生物素酶缺乏的年长同胞的新生儿应在出生时用生物素进行处理,等待确定的生物素酶活性测定结果和/或分子遗传学检测(如果该家族中的BTD致病变异已知)。
具有生物素酶缺乏症的儿童的同胞(即使无症状)的遗传状态应通过生物素酶活性测定或分子遗传学检测(如果已知家族中的BTD致病变体)澄清,以便可以制定生物素治疗及时。
具有与生物素酶缺乏症相符的症状的任何亲属的遗传状态应通过生物素酶活性测定或分子遗传学检测(如果已知家族中的BTD致病变异)来澄清,以便可以及时制定生物素治疗。
有关为Genetic Counseling目的测试有风险亲属的相关问题,请参阅遗传咨询。
怀孕管理
对于携带生物素酶缺乏症或有生育素缺乏症婴儿风险的妇女而言,唯一的特殊怀孕管理考虑因素是考虑母亲补充生物素。 尚未确定最佳产前剂量。
正在调查的疗法
在ClinicalTrials.gov中搜索有关各种疾病和病症的临床研究信息。 注意:这种疾病可能没有临床试验。
遗传咨询
遗传咨询是向个人和家庭提供有关遗传疾病的性质,遗传和影响的信息的过程,以帮助他们做出明智的医疗和个人决定。 以下部分涉及遗传风险评估以及使用家族史和基因检测来阐明家庭成员的遗传状况。 本节不是为了解决个人可能面临的所有个人,文化和矿物问题,也不是用遗传专业人员代替咨询。-编者.
遗传模式
生物素酶缺乏症的遗传模式是常染色体隐性遗传.
家庭成员的风险
先证者的父母
- 患有生物素酶缺乏症的儿童的父母是专性杂合子(即一种BTD的携带致病性变异).
- 杂合子无症状,没有患上这种疾病的风险
先证者的同胞
- 患有生物素酶缺乏症的个体的每个同胞有25%的机会 受累的,有50%的机会成为无症状 携带者,25%的机会不受影响且不是携带者。
- 患有生物素酶缺乏症的个体的同胞即使没有出现症状,也应该检测其缺陷。
- 杂合子(携带者)是无症状的,并且没有患上这种疾病的风险。
先证者的后代
- 具有生物素酶缺乏的个体的所有后代都是BTD的肯定杂合子(携带者) 致病性变异.
携带(杂合子)检测
分子遗传学测试 对有风险的亲属进行携带检测需要事先确定该家族中的BTD致病变异。
生化基因检测 载体(杂合子)通常具有介于 受累的和正常个体之间的血清酶活性水平 [Wolf et al 1983a]。 利用血清酶活性,可以以大约95%的准确度诊断杂合性 [Weissbecker et al 1991]。 然而,如果已经鉴定了该家族中的BTD致病变异,则优选分子检测。
相关的遗传咨询问题
有关为早期诊断和治疗目的Evaluation of Relatives at Risk的信息,请参阅管理,评估风险亲属。
家庭计划
- 确定遗传风险的最佳时间,携带者状态的澄清以及产前检测可用性的讨论是在怀孕前进行的。
DNA库 是DNA的存储(通常从白细胞中提取),以备将来使用。因为测试方法和我们对基因,等位基因变体和疾病的理解将来可能会有所改善,所以应该考虑 受累的个体的银行DNA。
产前检查和植入前遗传学诊断
分子遗传学测试 一旦在受累的家庭成员中鉴定出BTD致病变异,就可能选择产前检测和植入前遗传诊断 以减少生物素酶缺乏风险的妊娠。
酶活性 通过测量培养的羊水细胞和通过羊膜穿刺术获得的羊水中的生物素酶活性,可以对生物素酶缺乏风险增加的妊娠进行产前诊断Secor McVoy et al 1984, Chalmers et al 1994]。在美国,分子产前检测是可行的并且是优选的。
医疗专业人员和家庭中可能存在关于使用产前检查的观点差异,特别是如果考虑将检测用于终止妊娠而不是早期诊断。虽然大多数中心会考虑将产前检查的决定作为父母的选择,但对这些问题的讨论是恰当的。
资源
GeneReviews的工作人员选择了以下疾病特异性和/或orumbrella支持组织和/或登记处,以使这种疾病患者及其家人受益。 GeneReviews不对其他组织提供的信息负责。 有关selectioncriteria的信息,请单击 here.
- Biotinidase Deficiency Family Support Group
- Biotinidase Deficiency: A Booklet for Families and Professionals
- My46 Trait Profile
- National Library of Medicine Genetics Home Reference
- Save Babies Through Screening Foundation, Inc.P. O. Box 42197Cincinnati OH 45242Phone: 888-454-3383Email: email@savebabies.org
- Association for Neuro-Metabolic Disorders (ANMD)5223 Brookfield LaneSylvania OH 43560-1809Phone: 419-885-1809; 419-885-1497Email: volk4olks@aol.com
分子遗传
Molecular Genetics和OMIM表中的信息可能与GeneReview中的其他信息不同:表格可能包含更多最新信息。 - ED
Table A.
生物素酶缺乏症:基因和数据库
| 基因 | 染色体定位 | 蛋白 | 数据库 | HGMD |
|---|---|---|---|---|
| BTD | 3p25 | Biotinidase | Biotinidase Deficiency (BTD) BTD @ LOVD | BTD |
生物素酶缺乏症的OMIM条目 (View All in OMIM)
基因结构 BTD由四个外显子组成 [Knight et al 1998]。 基因中存在两个推定的翻译起始密码子:一个在 外显子1内编码,另一个在外显子2内编码,其含有成熟酶的N-末端甲硫氨酸。 在两个可能的起始密码子之间存在 内含子可以允许替代剪接,其可以产生编码具有41或21残基信号肽的蛋白质的转录物。 有关基因和蛋白质信息的详细摘要,请参阅Table A,基因。
致病等位基因变异 已经在具有严重生物素酶缺乏症的有症状儿童中描述了近200种致病变异。
已经建立了不断更新的当前致病变异数据库[Procter et al 2013], 见www.arup.utah.edu。Table 2.
选择的BTD致病等位变异
| DNA 核苷酸改变 (Alias 1) | 预测的蛋白质改变 | 参考序列 |
|---|---|---|
| c.98_104delinsTCC (G98del3ins) | p.Cys33PhefsTer36 | NM_000060 NP_000051 |
| c.511G>A | p.Ala171Thr | |
| c.1330G>C | p.Asp444His | |
| c.1368A>C | p.Gln456His | |
| c.1612C>T | p.Arg538Cys |
关于变异分类的注意事项:表中列出的变异由作者提供。 GeneReviews工作人员尚未独立验证变异的分类。
关于命名法的注释:GeneReviews遵循人类基因组变异学会(varnomen- .hgvs.org )的标准命名惯例。 有关术语的解释,请参见Quick Reference。- 1.
变异名称不符合当前的命名约定。Variant designation that does not conform to current naming conventions.
正常基因产物 生物素酶对于维生素生物素的再循环至关重要 [Wolf et al 1985a]。 已显示生物素酶具有生物素水解酶和生物素基转移酶活性(参见Abnormal gene product)[Hymes & Wolf 1996]。
相对于第一个ATG密码子,BTD cDNA具有两个可能的ATG起始密码子和1629bp的开放阅读框架[Cole et al 1994]。 该cDNA编码543个氨基酸的成熟蛋白质,分子量为56,771d。 成熟血清生物素酶的氨基末端与两个ATG密码子处于相同的阅读框架中,与两个推定的信号肽一致。 BTD在人肺,肝,骨骼肌,肾,胰腺,心脏,脑和胎盘中表达。 该酶是单体唾液酸化糖蛋白,具有多种异型体,由唾液酸化程度的差异引起[Hart et al 1991]。
异常基因产物 生物素酶活性的丧失与疾病有关 [Hymes & Wolf 1996]。
References
Published Guidelines/Consensus Statements
- Cowan TM, Blitzer MG, Wolf B; Working Group of the American College of Medical Genetics Laboratory Quality Assurance Committee. Technical standards and guidelines for the diagnosis of biotinidase deficiency. Available online. Accessed 6-6-16. [PubMed: 20539236]
Literature Cited
- Baykal T, Gokcay G, Gokdemir Y, Demir F, Seckin Y, Demirkol M, Jensen K, Wolf B. Asymptomatic adults and older siblings with biotinidase deficiency ascertained by family studies of index cases. J Inherit Metab Dis. 2005;28:903 - 12. [PubMed: 16435182]
- Burton BK, Roach ES, Wolf B, Weissbecker KA. Sudden death associated with biotinidase deficiency. Pediatrics. 1987;79:482 - 3. [letter] [PubMed: 3822661]
- Chalmers RA, Mistry J, Docherty PW, Stratton D. First trimester prenatal exclusion of biotinidase deficiency. J Inherit Metab Dis. 1994;17:751 - 2. [PubMed: 7707701]
- Chedrawi AK, Ali A, Al Hassnan ZN, Faiyaz-Ul-Haque M, Wolf B. Profound biotinidase deficiency in a child with predominantly spinal cord disease. J Child Neurol. 2008;23:1043 - 8. [PubMed: 18645204]
- Cole H, Reynolds TR, Lockyer JM, Buck GA, Denson T, Spence JE, Hymes J, Wolf B. Human serum biotinidase. cDNA cloning, sequence, and characterization. J Biol Chem. 1994;269:6566 - 70. [PubMed: 7509806]
- Cowan TM, Blitzer MG, Wolf B. Technical standards and guidelines for the diagnosis of biotinidase deficiency. Genet Med. 2010;12:464 - 70. [PubMed: 20539236]
- Cowan TM, Kazerouni NN, Dharajiya N, Lorey F, Roberson M, Hodgkinson C, Schrijver I. Increased incidence of profound biotinidase deficiency among Hispanic newborns in California. Mol Genet Metab. 2012;106:485 - 7. [PubMed: 22698809]
- Grünewald S, Champion MP, Leonard JV, Schaper J, Morris AA. Biotinidase deficiency: a treatable leukoencephalopathy. Neuropediatrics. 2004;35:211 - 6. [PubMed: 15328559]
- Hart PS, Hymes J, Wolf B. Isoforms of human serum biotinidase. Clin Chim Acta. 1991;197:257 - 64. [PubMed: 2049867]
- Hymes J, Wolf B. Biotinidase and its roles in biotin metabolism. Clin Chim Acta. 1996;255:1 - 11. [PubMed: 8930409]
- Knight HC, Reynolds TR, Meyers GA, Pomponio RJ, Buck GA, Wolf B. Structure of the human biotinidase gene. Mamm Genome. 1998;9:327 - 30. [PubMed: 9530634]
- Küry S, Ramaekers V, Bézieau S, Wolf B. Clinical utility gene card for: biotinidase deficiency. Eur J Hum Genet. 2012;20(5) [PMC free article: PMC3330233] [PubMed: 22378278]
- Lott IT, Lottenberg S, Nyhan WL, Buchsbaum MJ. Cerebral metabolic change after treatment in biotinidase deficiency. J Inherit Metab Dis. 1993;16:399 - 407. [PubMed: 8412000]
- Möslinger D, Mühl A, Suormala T, Baumgartner R, Stöckler-Ipsiroglu S. Molecular characterisation and neuropsychological outcome of 21 patients with profound biotinidase deficiency detected by newborn screening and family studies. Eur J Pediatr. 2003;162 Suppl 1:S46 - 9. [PubMed: 14628140]
- Möslinger D, Stockler-Ipsiroglu S, Scheibenreiter S, Tiefenthaler M, Muhl A, Seidl R, Strobl W, Plecko B, Suormala T, Baumgartner ER. Clinical and neuropsychological outcome in 33 patients with biotinidase deficiency ascertained by nationwide newborn screening and family studies in Austria. Eur J Pediatr. 2001;160:277 - 82. [PubMed: 11388594]
- Neto EC, Schulte J, Rubim R, Lewis E, DeMari J, Castilhos C, Brites A, Giugliani R, Jensen KP, Wolf B. Newborn screening for biotinidase deficiency in Brazil: biochemical and molecular characterizations. Braz J Med Biol Res. 2004;37:295 - 9. [PubMed: 15060693]
- Procter M, Wolf B, Crockett DK, Mao R. The Biotinidase Gene Variants Registry: A Paradigm Public Database. G3 (Bethesda). 2013 Mar 11. pii: g3.113.005835v1. [PMC free article: PMC3618359] [PubMed: 23550138]
- Ramaekers VT, Brab M, Rau G, Heimann G. Recovery from neurological deficits following biotin treatment in a biotinidase Km variant. Neuropediatrics. 1993;24:98 - 102. [PubMed: 8352834]
- Ramaekers VT, Suormala TM, Brab M, Duran R, Heimann G, Baumgartner ER. A biotinidase Km variant causing late onset bilateral optic neuropathy. Arch Dis Child. 1992;67:115 - 9. [PMC free article: PMC1793569] [PubMed: 1739323]
- Salbert BA, Astruc J, Wolf B. Ophthalmologic findings in biotinidase deficiency. Ophthalmologica. 1993a;206:177 - 81. [PubMed: 8278163]
- Salbert BA, Pellock JM, Wolf B. Characterization of seizures associated with biotinidase deficiency. Neurology. 1993b;43:1351 - 5. [PubMed: 8327137]
- Senanayake D.N., Jasinge E.A., Pindolia K., Wanigasinghe J., Monaghan K., Suchy S.F., Wei S., Jaysena S., Wolf B. First contiguous gene deletion causing biotinidase deficieincy: The enzyme deficiency in three Sri Lankan Children. Mol Genet Metabol. Reports. 2015;2:81 - 84. [PMC free article: PMC5471155] [PubMed: 28649532]
- Secor McVoy JR, Heard GS, Wolf B. Potential for prenatal diagnosis of biotinidase deficiency. Prenat Diagn. 1984;4:317 - 8. [letter] [PubMed: 6483793]
- Sivri HS, Genc GA, Tokatli A, Dursun A, Coskun T, Aydin HI, Sennaroglu L, Belgin E, Jensen K, Wolf B. hearing loss in biotinidase deficiency: genotype-phenotype correlation. J Pediatr. 2007;150:439 - 42. [PubMed: 17382128]
- Suormala T, Wick H, Bonjour JP, Baumgartner ER. Rapid differential diagnosis of carboxylase deficiencies and evaluation for biotin-responsiveness in a single blood sample. Clin Chim Acta. 1985;145:151 - 62. [PubMed: 3918814]
- Swango KL, Demirkol M, Huner G, Pronicka E, Sykut-Cegielska J, Schulze A, Mayatepek E, Wolf B. Partial biotinidase deficiency is usually due to the D444H mutation in the biotinidase gene. Hum Genet. 1998;102:571 - 5. [PubMed: 9654207]
- Taitz LS, Leonard JV, Bartlett K. Long-term auditory and visual complications of biotinidase deficiency. Early Hum Dev. 1985;11:325 - 31. [PubMed: 4054050]
- Tokatli A, Coskun T, Ozalp I. Biotinidase deficiency with neurological features resembling multiple sclerosis. J Inherit Metab Dis. 1997;20:707 - 8. [PubMed: 9323568]
- Wastell HJ, Bartlett K, Dale G, Shein A. Biotinidase deficiency: a survey of 10 cases. Arch Dis Child. 1988;63:1244 - 9. [PMC free article: PMC1779020] [PubMed: 3196050]
- Weber P, Scholl S, Baumgartner ER. Outcome in patients with profound biotinidase deficiency: relevance of newborn screening. Dev Med Child Neurol. 2004;46:481 - 4. [PubMed: 15230462]
- Weissbecker KA, Nance WE, Eaves LJ, Piussan C, Wolf B. Statistical approaches for the detection of heterozygotes for biotinidase deficiency. Am J Med Genet. 1991;39:385 - 90. [PubMed: 1877614]
- Wolf B. Worldwide survey of neonatal screening for biotinidase deficiency. J Inherit Metab Dis. 1991;14:923 - 7. [PubMed: 1779651]
- Wolf B. Disorders of biotin metabolism. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic and Molecular Bases of Inherited Disease. 7 ed. New York, NY: McGraw-Hill; 1995:3151-77.
- Wolf B. Children with profound biotinidase deficiency should be treated with biotin regardless of their residual enzyme activity or genotype. Eur J Pediatr. 2002;161:167 - 8. [PubMed: 11998918]
- Wolf B. Biotinidase deficiency: new directions and practical concerns. Curr Treat Options Neurol. 2003;5:321 - 328. [PubMed: 12791199]
- Wolf B. Clinical issues and frequent questions about biotinidase deficiency. Mol Genet Metab. 2010;100:6 - 13. [PubMed: 20129807]
- Wolf B. The neurology of biotinidase deficiency. Mol Genet Metab. 2011;104:27 - 34. [PubMed: 21696988]
- Wolf B. Biotinidase deficiency: "if you have to have an inherited metabolic disease, this is the one to have. Genet Med. 2012;14:565 - 75. [PubMed: 22241090]
- Wolf B. Biotinidase deficiency should be considered in individuals exhibiting myelopathy with or without and vision loss. Mol Genet Metab. 2015;116:113 - 8. [PubMed: 26358973]
- Wolf B. First microdeletion involving only the biotinidase gene that can cause biotinidase deficiency: A lesson for clinical practice. Mol Genet Metab Rep. 2016;6:74 - 6. [PMC free article: PMC4789387] [PubMed: 27014582]
- Wolf B, Grier RE, Allen RJ, Goodman SI, Kien CL. Biotinidase deficiency: the enzymatic defect in late-onset multiple carboxylase deficiency. Clin Chim Acta. 1983a;131:273 - 81. [PubMed: 6883721]
- Wolf B, Grier RE, Heard GS. Hearing loss in biotinidase deficiency. Lancet. 1983b;2:1365 - 6. [PubMed: 6139700]
- Wolf B, Grier RE, Secor McVoy JR, Heard GS. Biotinidase deficiency: a novel vitamin recycling defect. J Inherited Metab Dis. 1985a;8 Suppl 1:53 - 8. [PubMed: 3930841]
- Wolf B, Heard GS. Disorders of biotin metabolism. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic Basis of Inherited Disease. 6 ed. New York, NY: McGraw-Hill; 1989:2083-103.
- Wolf B, Heard GS, Weissbecker KA, McVoy JR, Grier RE, Leshner RT. Biotinidase deficiency: initial clinical features and rapid diagnosis. Ann Neurol. 1985b;18:614 - 7. [PubMed: 4073853]
- Wolf B, Norrgard K, Pomponio RJ, Mock DM, McVoy JR, Fleischhauer K, Shapiro S, Blitzer MG, Hymes J. Profound biotinidase deficiency in two asymptomatic adults. Am J Med Genet. 1997;73:5 - 9. [PubMed: 9375914]
- Wolf B, Pomponio RJ, Norrgard KJ, Lott IT, Baumgartner ER, Suormala T, Ramaekers VT, Coskun T, Tokatli A, Ozalp I, Hymes J. Delayed-onset profound biotinidase deficiency. J Pediatr. 1998;132:362 - 5. [PubMed: 9506660]
- Wolf B, Spencer R, Gleason T. Hearing loss is a common feature of symptomatic children with profound biotinidase deficiency. J Pediatr. 2002;140:242 - 6. [PubMed: 11865279]
Suggested Reading
- Procter M, Mao R, Wolf B. ARUP Online Scientific Resource: Biotinidase Deficiency and BTD. Available online. Accessed 6-6-16.
- Wolf B. Disorders of biotin metabolism: treatable neurological syndromes. In: Rosenberg R, DiMauro S, Paulson HL, Ptacek L, Nestler EJ, eds. The Molecular and Genetic Basis of Neurologic and Psychiatric Disease. Philadelphia, PA: Wolters Kluwer-Lippincott Williams and Wilkins; 2001:739-45.
Chapter Notes
Author Notes
The author's laboratory was the first to describe biotinidase deficiency in individuals with late-onset multiple carboxylase deficiency and has characterized the clinical, biochemical, and molecular features of the disorder. They developed the method used to screen newborns for biotinidase deficiency and piloted the first 新生儿筛查 for the disorder. They currently confirm the diagnosis of the enzyme deficiency in a majority of children in the United States and collaborate with laboratories in the US and around the world in determining the mutations that cause profound and partial biotinidase deficiency. Dr. Wolf's laboratory accepts DNA from children with biotinidase deficiency for 分子遗传学检测 on an experimental basis. He is also currently studying the outcomes of children with biotinidase deficiency identified by newborn screening.
Biotinidase Deficiency: A Booklet for Families and Professionals
by DL Thibodeau, MS, and B Wolf, MD, PhD
Revision History
- 9 June 2016 (bp) Comprehensive update posted live
- 5 December 2013 (me) Comprehensive update posted live
- 15 March 2011 Comprehensive update posted live
- 25 September 2008 (me) Comprehensive update posted live
- 2 March 2006 (me) Comprehensive update posted to live Web site
- 10 February 2005 (bw,cd) Revision: 靶性性突变分析 clinically available
- 26 November 2003 (me) Comprehensive update posted to live Web site
- 27 September 2001 (me) Comprehensive update posted to live Web site
- 24 March 2000 (pb) Review posted to live Web site
- December 1999 (bw) Original submission