概要
临床特征.
Best卵黄样黄斑营养不良是一种进展缓慢的黄斑营养不良症,通常在儿童时期发病,有时在青少年后期发病。受影响的个体最初视力正常,随后中央视力迅速下降和具有视物变形症。患者通常保留正常的周边视觉和暗适应。发病的年龄和视力丧失的严重程度表现出家系内差异。
诊断/检测.
Best卵黄样黄斑营养不良的诊断建立于眼底的表现、眼电图(EOG)和家族史。受累的个体眼底检查通常有典型的卵黄样黄斑病变。病变通常是双侧的,但也可能是单侧的。EOG间接的测量眼睛的静息电位。正常的光峰/暗谷比(Arden比)大于1.8。在Best卵黄样黄斑营养不良个体中,EOG是异常的,其光峰/暗谷比值降低几乎总是小于1.5,一般在1.0和1.3之间。这些个体的Arden比随着年龄的增长而保持不变。 BEST1 (VMD2) 基因是唯一已知相关基因,其致病性变异会导致Best卵黄样黄斑营养不良。
管理.临床表现的治疗: 需要低视力辅助。直接激光光凝术和抗血管内皮生长因子(anti-VEGF)应用于脉络膜新血管形成和出血。
监测: 各年龄层每年进行眼科检查。
避免接触有害物质/环境: 吸烟。
遗传咨询.
Best卵黄样黄斑营养不良通常以常染色体显性遗传方式遗传;然而,已有3个家庭报道以常染色体隐性遗传方式遗传。对于常染色体显性Best卵黄样黄斑营养不良:
- 大多数被诊断为Best卵黄样黄斑营养不良的个体父母其中一个也受累。
- 新发的致病性变异的比例还未知。
- 患有Best卵黄样黄斑营养的个体的每一个孩子都有50%的概率遗传到致病性变异。
- 如家系中致病变异已知,可对高危孕妇进行产前诊断。
诊断
临床诊断
Best卵黄样黄斑营养不良的诊断以眼底表现、眼电图(EOG)和家族史为依据。
眼底表现. 受累的个体眼底检查通常有典型的卵黄样黄斑病变。病变通常是双侧的,但也可能是单侧的。至少四分之一的人有多发性病变和黄斑以外的病变。参见 Figure 1, Figure 2, Figure 3.
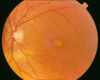
Figure 1.
卵黄形成阶段 (Stage 2)
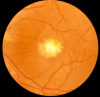
Figure 2.
假性积浓 (Stage 3)
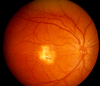
Figure 3.
中央瘢痕 (Stage 4b)
以下临床阶段已被用于描述,但要注意的是,并不是每个阶段都会在每个患者中进展:
- Stage 0. 正常黄斑。正常EOG。
- Stage 1. 黄斑区视网膜色素上皮(RPE)破裂。荧光素血管造影(FA)显示窗样缺损。
- Stage 2. 圆形的,边界清楚的,黄色不透明的,均匀的类似蛋黄的黄斑病变(卵黄样病变)(参见 Figure 1). FA在病灶覆盖区域显示明显的低荧光。
- Stage 2a. 卵黄样病变内容物变得不均匀,形成“炒蛋”样外观。FA表现局部荧光堵塞伴有非均匀的低荧光。
- Stage 3. 假性积浓阶段 (参见 Figure 2). 病灶发展为黄色卵黄样物质的液平面。FA由于被卵黄样物质堵塞而表现出更差的低荧光,同时伴有较好的高荧光缺陷。
- Stage 4a. 橙红色病灶伴有萎缩性RPE和可见的脉络膜。FA呈高荧光无渗漏。
- Stage 4b. 黄斑纤维性瘢痕 (参见 Figure 3). FA呈高荧光无渗漏。
- Stage 4c. 纤维性瘢痕或视网膜下出血时出现脉络膜新生血管。FA由于新血管形成和渗漏而表现出高荧光。
电生理学
- 眼电图(EOG)间接测量眼睛的静息电位:
- 正常的光峰/暗谷比(Arden比)大于1.8(Arden比在第四个十年后随年龄增长而下降;这个值不是绝对的)。
- 在患有Best卵黄样黄斑营养不良的个体中,EOG通常是不正常的,其光峰/暗谷比值(Arden比)低于1.5,通常在1.0和1.3之间。
注意:在临床发现携带有BEST1致病性变异的Best卵黄样黄斑营养不良的个体中,有时EOG正常 [Testa et al 2008]。
- 全视野视网膜电图(ERG)正常。中心凹ERG或多焦点ERG显示中央振幅降低 [Scholl et al 2002, Palmowski et al 2003]。 多焦点ERG (mfERG)异常区域与光学相干断层扫描(OCT)和视网膜摄影确定的临床异常区域相匹配 [Glybina & Frank 2006]。 多焦ERG诱发的扫描激光检眼镜用于Best卵黄样黄斑营养不良患者视网膜功能的地形图绘制 [Rudolph & Kalpadakis 2003], 显示黄斑内振幅明显降低。
色觉测试. 相当比例的个体具有异常的颜色辨别能力,特别是在红-绿色轴上。颜色视觉的改变是非特异性的和非诊断性的。
关系相干断层成像术 (OCT). 这种成像方法可以揭示Best卵黄样黄斑营养不良个体视网膜的横断面解剖 [Pianta et al 2003, Querques et al 2008]。 OCT在临床前期表现为正常的视网膜结构或视网膜外膜细微改变,在临床中期表现为视网膜外膜-视网膜色素上皮复合体分裂和升高,在临床萎缩期表现为视网膜和视网膜色素上皮的变薄。
眼底自发荧光 (AF). 这种成像模式在过去的十年中得到了显著的发展,因为它可以检测到视网膜色素上皮层(RPE)和感光层的代谢变化,否则在彩色眼底照片中可能无法检测到。AF的增加与眼底的病变相一致 [Boon et al 2008]。
家族史. 家族病史符合常染色体显性遗传或常染色体隐性遗传方式遗传。
分子遗传学检测
基因. BEST1 (VMD2) 基因是唯一已知的相关基因,其致病性变异会导致Best卵黄样黄斑营养不良 [Marquardt et al 1998, Petrukhin et al 1998, Allikmets et al 1999, Krämer et al 2000, White et al 2000, Seddon et al 2001]。
位点异质性证据. 患有Best卵黄样黄斑营养不良的个体未检测到致病性变异已被报道过。
- 原因可能是基因的序列分析不能检测外显子缺失和内含子致病性或者5' 端和 3'端的非编码区域This may result from the failure of 序列分析 to detect 外显子 deletions and pathogenic variants in introns or untranslated 5' and 3' regions of the 基因 [Petrukhin et al 1998, Bakall et al 1999, Caldwell et al 1999, Krämer et al 2000, White et al 2000].
- 也可能是其他基因致病性变异导致相似的表型。例如,Boon et al [2007] 报道了1个患者,他的BEST1基因没有发现致病性变异,但是其PRPH2(RDS)基因的5’端非编码区有一个序列变异。在一个成人发病的卵黄样黄斑营养不良患者中发现PRPH2基因一个p.Pro210Arg致病性变异。 [Zhuk & Edwards 2006]。
临床检测
Table 1.
Best卵黄样黄斑营养不良的分子遗传学检测概要
| 基因 1 | 检测方法 | 等位基因变异检测 2 | 该检测方法检出致病性变异比例 3 | |
|---|---|---|---|---|
| 家族史 | ||||
| 阳性 | 阴性 | |||
| BEST1 | 序列分析 4 | 序列变异 | 96% 5 | 50%-70% 6 |
| 缺失/重复分析 7 | 部分或全基因缺失/重复 | 未知;未报道 8 | ||
| 致病性变异靶向分析 | c.383G>C | 瑞典人家系大部分受累的个体 9 | ||
- 1.
- 2.
- 3.
不同检测方法检测到该基因上变异的能力。
- 4.
- 5.
在一个阳性家族中,受累的个体检测致病性变异高达96% [Krämer et al [2000]。
- 6.
在没有家族史的Best卵黄样黄斑营养不良个体中,检测到致病性变异的比例大约在50%到70%之间 [Krämer et al 2000, White et al 2000]。
- 7.
序列分析不能用于检测基因组DNA编码区外显子或全基因缺失/重复和侧翼内含子区域的检测。可以使用的多种方法包括:定量PCR,长片段PCR,多重连接依赖性探针扩增(MLPA)和包括该基因/染色体片段的染色体微阵列(CMA)技术。
- 8.
该基因缺失/重复导致Best卵黄样黄斑营养不良的病例还未见报道。
- 9.
BEST1 c.383G>C (p.Trp93Cys) 变异的个体的祖先可以追溯到到一个庞大的瑞典家系 ("家系 S1") [Petrukhin et al 1998]
检测特点. 参见 Clinical Utility Gene Card [Ramsden et al 2012] 以获取检测的敏感性和特异性特点。
检测策略
在先证者中建立诊断
- 靶向分析. 瑞典血统的疑似Best卵黄样黄斑营养不良的个体建议先对c.383G>C致病性变异进行靶向检测。如果未检测到这个变异,那么整个基因的序列分析可能可以检测到致病变异。
- 单基因检测. 怀疑患有Best卵黄样黄斑营养不良先证者的分子诊断,一种检测策略是对BEST1基因进行序列分析。
- 多基因包. 对一些现先证者来说,可以考虑使用眼科遗传病表型靶向检测,它包括BEST1基因。这些检测包包含的基因因使用的方法和不同而有所不同;因此,每一个检测包检测某一特定个体的致病变异的能力也各不相同。
预测性检测. 在有发现致病性变异的家族中,高危无症状的成年家庭成员需要预测性检测(为了明确遗传状况),之前需要确定致病性变异(s)的家庭。
高风险家属携带者检测(在那些罕见的常染色体隐性遗传家系中).在有发现致病性变异的家族中,需要对高风险家属进行携带者检测。
产前诊断和植入前遗传诊断(PGD).在有发现致病性变异的家族中,需要对高风险孕妇进行产前诊断和植入前遗传诊断。
临床特征
临床描述
Best卵黄样黄斑营养不良是一种进展缓慢的黄斑营养不良症,通常在儿童时期发病,有时在青少年后期发病。视网膜的发现通常在出生时不存在,通常在5到10岁时才会出现。Best卵黄样黄斑营养不良以视力正常随后中央视野下降和视物变形症为特征(Table 2)。临床表现和起病年龄是可变的 (Table 3)。 部分受累的个体保留正常的视力,然而另一些有明显的视觉缺陷。周边视野和暗适应一般是正常的。
携带BEST1双等位基因的致病性变异的个体的非典型表现已被报道。受累的个体可能表现出多发性卵黄样病灶,纤维性病灶,或者在一个家族中表型各异。所有受累的个体都有异常的EOG;一部分有异常的的ERG [MacDonald et al 2012, Boon et al 2013]。
影响疾病严重程度的遗传或环境因素是未知的。
Table 2.
Best卵黄样黄斑营养不良的疾病进展分期
| 分期 | 特征 |
|---|---|
| 0 & 1 |
|
| 2 & 3 |
|
| 4 |
|
Table 3.
Best卵黄样黄斑营养不良的年龄和疾病进展
| 年龄 | 视敏度 |
|---|---|
| ≤40岁 |
|
| ≥50岁 |
|
组织病理学. 光镜和电镜显示,脂褐质颗粒在视网膜黄斑内的RPE内异常堆积,在黄斑和视网膜的其余部分也有分布。
基因型-表型关联
基因型-表型相关性尚未被证实。
致病性变异与个体表型的特异性或者视力缺损的程度相关联的信息较少。然而Eksandh et al [2001] 报道了一个携带有p.Val89Ala的家族,其视力缺失表现发病晚(40-50岁)。
Mullins et al [2005] 报道了一个携带有p.Tyr227Asn的家族有晚发的小的卵黄样病变。
3个携带复合杂合致病性变异的常染色体隐性遗传Best卵黄样黄斑营养不良的家庭已被报道 [Bitner et al 2011, Iannaccone et al 2011, Zhao et al 2012]. 来自3个不同家庭的6个儿童被发现有BEST1双等位基因致病性变异。其中4个受累的个体有多发性卵黄样病变。 2个个体有c.1415delT纯合变异,1个个体有p.Arg141Ser和p.Arg141His复合杂合变异,3个个体有p.Leu41Pro和p.Ile201Thr符合杂合变异。杂合子携带者没有表型。
外显率
Best卵黄样黄斑营养不良一般是完全外显的,特别是当EOG被用于作为临床表现的证据时。不完全外显的证据尚未见报道。
遗传早现
Best卵黄样黄斑营养不良遗传早现尚未见报道。
命名规则
以下几种命名已被使用:
- Best病 Best disease
- 早发性卵黄样黄斑营养不良 Vitelliform macular dystrophy, early onset
- 青少年起病型卵黄样黄斑营养不良 Vitelliform macular dystrophy, juvenile onset
- 成人起病型卵黄样黄斑营养不良 Vitelliform macular dystrophy, adult onset
- 多形性卵黄样黄斑变异 Macular degeneration, polymorphic vitelline
发病率Prevalence
Best卵黄样黄斑营养不良是一种罕见病。发病率未知。
遗传相关(等位基因)疾病
BEST1基因的致病性变异已被发现于:
- 8个牛眼黄斑病变个体 [Seddon et al 2001];
- 2个成人起病卵黄样黄斑病变 (AVMD) 个体[Krämer et al 2000] (也可参见鉴别诊断);
- 常染色体显性遗传玻璃体视网膜脉络膜病 (ADVIRC) 伴真性小眼球家族。 [Yardley et al 2004]. 有ADVIRC的病人表现为真性小眼球,小角膜,闭角型青光眼,先天的白内障(后囊下的),和视网膜营养不良。视网膜营养不良的特征是周围视网膜色素趁着、白色的视网膜前混浊、明显的黄斑囊性水肿、视网膜新生血管、脉络膜萎缩,玻璃体的纤维性凝结。ERG和EOG异常。. ADVIRC是由BEST1基因可变mRNA剪接的致病性变异导致 [Burgess et al 2009]。
- 常染色体隐性遗传斑萎蛋白病(ARB)的个体:
- BEST1双等位基因的致病性变异(双等位基因的突变)比Best卵黄样黄斑营养不良导致更严重视网膜病变已经在瑞典血统的个人,他们携带有两个错义突变。 [Schatz et al 2006]。
- 相似的,一种常染色体隐性遗传斑萎蛋白病已被发现 [Burgess et al 2008],表现为视锥视杆细胞营养不良,ERG异常,EOG的Arden比显著降低。 受累的个体有视网膜下白色沉积物和黄斑的视网膜下液体,可能提示诊断。携带有一个等位基因缺失或者无义突变的个体可能没有临床表现或者电生理异常。
鉴别诊断
Best卵黄样营养不良容易通过明显的黄斑变性诊断。以下视网膜病变需要与Best卵黄样营养不良相鉴别 [Allikmets et al 1999, Krämer et al 2000, White et al 2000, Seddon et al 2001]:
- 成人起病卵黄样黄斑营养不良 (AVMD). 这是一个常染色体显性遗传病,特征是存在双边的,小的,圆形的,黄色的,均匀的视网膜下病变伴有脉络膜玻璃膜疣样病灶,受累的通常是中年的个体。这些患者眼底镜的发现很容易被误诊为Best卵黄样营养不良,但是EOG是正常的或者只有轻微的减少。PRPH2 (RDS) (其编码外周蛋白) 和 BEST1 基因的致病性变异已被发现在一小部分AVMD患者中,显示出该疾病的遗传异质性。[Renner et al 2004, Yu et al 2006, Zhuk & Edwards 2006]. AVMD与Best卵黄样营养不良的表现显著重叠。使用OCT发现两种疾病的卵黄样病变结构相似 Hayami et al [2003] 。
- 年龄相关黄斑变性 (AMD). 这种常见的疾病以脉络膜玻璃膜疣,RPE断裂和脉络膜新生血管为特征。多个证据表明AMD有家族性组成现象。 一些基因 (包括CFH, CFB, ABCA4, TIMP3, and EFEMP1) 的致病性变异与AMD相关联 [Patel et al 2008]。一些罕见的AMD病例有BEST1基因致病性变异 [Allikmets et al 1999, Krämer et al 2000, Lotery et al 2000, Seddon et al 2001].
- 牛眼样黄斑病变. 这种描述性的临床诊断以黄斑中央RPE脱色的环状区域为特点 [Seddon et al 2001]. 在患者中可以看到视锥萎缩,视锥视杆细胞营养不良,Stargardt病,黄斑病变,氯喹黄斑病变和其他黄斑病变。Seddon et al [2001] 发现一个牛眼样黄斑病变的患者携带有BEST1基因致病性变异。
管理
初诊后的评估
为了明确被诊断为Best卵黄样黄斑营养不良个体的疾病阶段和需求,应进行眼科检查。医学遗传学咨询也可以考虑。
对症治疗
低视力辅助设备为视敏度明显下降的人提供帮助。
4c期眼底病变或脉络膜新生血管和出血可采用直接激光光凝术治疗。Marano et al [2000] 提出了一种保守治疗脉络膜新生血管的方法,该方法以两例视力改善的Best卵黄样黄斑营养不良患者为研究对象。目前还没有临床试验比较激光光凝术和保守治疗的疗效。
Anti-VEGF(血管内皮生长因子)药物是治疗中央凹下脉络膜新生血管(CNV)的标准疗法. Leu et al [2007] 通过玻璃体腔内注射阿瓦斯汀治疗1例13岁的良性Best卵黄样黄斑营养不良和CNV患者,加速视力恢复及CNV消退。 玻璃体内注射兰尼单抗也获得了成功 [Querques et al 2009]。目前还没有关于阿柏西普使用的报告。长期追踪这些受累者是未知的。目前还没有临床试验证明anti-VEGF药物对Best卵黄样黄斑营养不良CNV的疗效。
Andrade et al [2003] 应用维替泊芬对1例Best卵黄样黄斑营养不良患者CNV进行光动力治疗(PDT)。CNV消退,并且视网膜下出血消失。作者认为PDT可能是治疗Best卵黄样黄斑营养不良CNV的一种选择。
应该提供遗传咨询和职业咨询。
监视
应每年进行眼科检查,以监测眼底病变的进展;在儿童时期,年度检查对预防弱视的发展很重要。受累的人应该被建议去看他们的眼科医生,如果视力下降或视力变形,这可能是CNV的迹象。
媒介/环境的避免
戒烟有助于防止视网膜新生血管再生 [Clemons et al 2005].
评估亲属风险
参见遗传咨询,用于与出于遗传咨询目的的高危亲属评估相关风险。
正在研究中的疗法
检索 ClinicalTrials.gov 以获得有关各种疾病和状况的临床研究信息。注意:目前这种疾病的临床试验并不多。
遗传咨询
遗传咨询是一个给患者及家属提供关于遗传性疾病本质、遗传特性以及影响并帮助他们做出知情的医疗决定的过程。下列段落描述遗传风险的评估以及根据家族史和基因检测判断家族成员遗传状态。本段落描述不适用于解决患者实际面对的个人、文化或伦理问题,也不能代替专业的遗传咨询。—ED.
遗传模式
Best卵黄样黄斑营养不良通常以常染色体显性遗传方式遗传;然而,已有3个携带复合杂合致病性变异的家庭被报道以常染色体隐性遗传方式遗传[Bitner et al 2011, Iannaccone et al 2011, Zhao et al 2012]。
家庭成员的风险 — 常染色体显性遗传
先证者的父母
- 大多数诊断为Best卵黄样黄斑营养不良个体都有一位受累的父亲或母亲。
- 患有Best卵黄样黄斑营养不良的先证者可能是由新发的致病性变异导致的[Apushkin et al 2006, Li et al 2006, Marchant et al 2007, Atchaneeyasakul et al 2008, Testa et al 2008]。新发致病性变异导致Best卵黄样黄斑营养不良的比例未知。
- 建议有致病性变异的先证者父母进行眼底检查。假定受累的个体眼底检查正常,EOG或者分子遗传学检测(假如这个家庭的致病性变异已被识别)可以用来诊断此病[White et al 2000].此病可能有单发的案例 (i.e., a single occurrence in a family) [Palomba et al 2000].
注意:虽然大多数被诊断患有Best卵黄样黄斑营养不良的人都有受累的父母,但由于未能识别其他家庭成员是否患病,家族史可能是阴性的。
先证者的同胞
先证者的子代. Best卵黄样黄斑营养不良个体的每个孩子都有50% 的概率遗传到致病性变异。
先证者其他家庭成员
家庭成员的风险 — 常染色体隐性遗传
先证者的父母
- 受累的患者父母一般为杂合子,携带一个等位基因突变。
- 迄今为止,常染色体隐性遗传Best卵黄样黄斑营养不良携带者一般无临床表型 [Zhao et al 2012].
先证者同胞
- 受累的患者同胞有25%概率受累,50%概率为无症状携带者,另有25%概率不受累且非携带者。
- 一个风险同胞如果未受累,那么他/她可能有2/3的概率为携带者。
- 常染色体隐性遗传Best卵黄样黄斑营养不良携带者一般无临床表型。
先证者的子代
- 常染色体隐性遗传Best卵黄样黄斑营养不良通常是致病性变异携带者。
- 常染色体隐性遗传Best卵黄样黄斑营养不良携带者一般无临床表型。
携带者检测
携带者检测前提是家系中患者已检出致病性变异。
遗传咨询相关问题
特殊风险问题. 受累个体的起病的年龄,疾病的临床表现和功能损伤程度是无法预测的。
一个家庭考虑为新发的致病性变异. 当 先证者父母双方均未患常染色体显性遗传Best卵黄样黄斑营养不良或其他可能为此病的表型时,先证者的致病变异可能是新发的,然而,需考虑可能的非医学解释包括 替代父亲或产妇(例如辅助生殖)或为秘密收养。
家庭计划
- 怀孕前是确定遗传风险和讨论产前检查可用性的最佳时间。
DNA银行是DNA(通常从白细胞中提取)的储存所,以备将来使用。因为测试方法和我们对基因、等位基因变异和疾病的理解可能会在将来得到改善,所以应考虑存储 受累个体的DNA。
产前检测
一旦致病性变异在一个受累的家系中检出,产前检测怀孕的风险可以由临床实验室提供检测这种疾病/基因或定制产前检测致病变异。
要求对不影响智力或寿命的疾病(如Best卵黄样黄斑营养不良)进行产前检查并不常见。医务工作者和患病家系成员对于产前诊断可能存在不同观点,尤其是当产前诊断涉及终止妊娠而不是早期诊断。尽管多数中心都认为产前诊断的决定交由怀孕夫妻双方决定,但这类问题需要被适当的讨论。
植入前遗传学诊断 (PGD) 对一些家庭来说可能是一个选项当致病性变异已明确时。
Resources
GeneReviews工作人员已经筛选了以下专科疾病和患者帮扶组织 ,注册登记能使患者及其家庭获益。 GeneReviews对该类组织提供的信息不负责,信息的筛选标准,参见此处 ( here)。
- Association for Macular Diseases210 East 64th Street8th FloorNew York NY 10065Phone: 212-605-3719Fax: 212-605-3795Email: association@retinal-research.org
- Macular Degeneration FoundationPO Box 531313Henderson NV 89053Phone: 888-633-3937 (toll-free); 702-450-2908Fax: 702-450-3396Email: liz@eyesight.org
- My46 Trait Profile
- National Library of Medicine Genetics Home Reference
- NCBI Genes and Disease
- Foundation Fighting Blindness11435 Cronhill DriveOwings Mills MD 21117-2220Phone: 800-683-5555 (toll-free); 800-683-5551 (toll-free TDD); 410-568-0150Email: info@fightblindness.org
- eyeGENE - National Ophthalmic Disease Genotyping Network RegistryPhone: 301-435-3032Email: eyeGENEinfo@nei.nih.gov
Molecular Genetics
分子遗传学检测的信息和OMIM相关列表可能同其它GeneReview信息会有不同。(可能有更新原因)—ED.
Table A.
Best卵黄样黄斑营养不良:基因和数据库
Table B.
OMIM 收录Best卵黄样黄斑营养不良信息参见 (View All in OMIM)
分子遗传学发病机制
Sun et al [2002] 报道了一个Best卵黄样黄斑营养不良新的氯离子通道家族的存在。他们利用异种表达研究证明,人类、果蝇和秀丽隐杆线虫卵黄状黄斑病蛋白均形成低聚氯离子通道。人类卵黄状黄斑病蛋白对胞内钙离子敏感。15个错义突变与膜电流点减少或消失有关。 Marmorstein et al [2002] 证明了卵黄状黄斑病蛋白发生了蛋白磷酸酶的去磷酸化作用。这一发现提示卵黄状黄斑病蛋白参与了一个信号转导通路,可能与EOG上的光峰值调节有关。目前有关Best卵黄样黄斑营养不良的遗传和分子信息发病机制尚不清楚。
正常等位基因变异.BEST1 有11个外显子. 大多数频繁的多态性和罕见的变异发生在非编码区域或不导致氨基酸取代 [White et al 2000]. Allikmets et al [1999] 还描述了三种意义不明得稀有氨基酸替换位于羧基端 (p.Glu525Ala, p.Glu557Lys, and p.Thr561Ala).
致病性等位基因变异. 一系列的错义突变已被发现 [Marquardt et al 1998, Petrukhin et al 1998, Allikmets et al 1999, Bakall et al 1999, Krämer et al 2000, White et al 2000, Seddon et al 2001, Krämer et al 2003]. White et al [2000] 回顾48个已报道案例的BEST1中致病性变异:45个错义突变,两个缺失,一个剪接位点突变。大多数变异发生在蛋白的前50%,在4在特定的位置 (外显子 2, 4, 6, and 8), 提示可能是具有重要功能的区域 [White et al 2000]. (需要更多信息, 参见 Table A. Genes and Databases.)
1个缺失变异已被 Caldwell et al [1999] 报道,涉及两个碱基对,导致阅读框的改变和蛋白质在氨基酸513处的截断。 1个影响5号外显子的剪接突变已被报道 Krämer et al [2000].
正常基因产物. 卵黄状黄斑病蛋白有585个氨基酸,大小为68kd [Petrukhin et al 1998]。亲水性分布图预测至少四个假定的跨膜域。卵黄状黄斑病蛋白已被发现在RPE高度表达并定位于基底外侧质膜 [Marmorstein et al 2000]。在RPE中,卵黄状黄斑病蛋白既可以作为氯离子通道,也可以作为电压门控钙离子通道的调节器 [Hartzell et al 2008, Yu et al 2008]。
异常基因产物. BEST1的致病性变异改变了RPE对卵黄状黄斑病蛋白和离子运输的作用,导致RPE和光感受器之间的液体积累 [Qu et al 2006, Yu et al 2007, Hartzell et al 2008].
注意引起AR疾病的变异携带者是无症状的 [Zhao et al 2012]. 这是假设是由于致病性变异,当杂合时,允许蛋白质作为离子通道或离子通道调节器保留足够水平的功能。
参考文献
文献引用
- Allikmets R, Seddon JM, Bernstein PS, Hutchinson A, Atkinson A, Sharma S, Gerrard B, Li W, Metzker ML, Wadelius C, Caskey CT, Dean M, Petrukhin K. Evaluation of the Best disease gene in patients with age-related macular degeneration and other maculopathies. Hum Genet. 1999;104:449 - 53. [PubMed: 10453731]
- Andrade RE, Farah ME, Costa RA. Photodynamic therapy with verteporfin for subfoveal choroidal neovascularization in best disease. Am J Ophthalmol. 2003;136:1179 - 81. [PubMed: 14644242]
- Apushkin MA, Fishman GA, Taylor CM, Stone EM. Novel de novo mutation in a patient with Best macular dystrophy. Arch Ophthalmol. 2006;124:887 - 9. [PubMed: 16769844]
- Atchaneeyasakul LO, Jinda W, Sakolsatayadorn N, Trinavarat A, Ruangvoravate N, Thanasombatskul N, Thongnoppakhun W, Limwongse C. Mutation analysis of the VMD2 gene in Thai families with Best macular dystrophy. Ophthalmic Genet. 2008;29:139 - 44. [PubMed: 18766995]
- Bakall B, Marknell T, Ingvast S, Koisti MJ, Sandgren O, Li W, Bergen AA, Andreasson S, Rosenberg T, Petrukhin K, Wadelius C. The mutation spectrum of the bestrophin protein — functional implications. Hum Genet. 1999;104:383 - 9. [PubMed: 10394929]
- Bitner H, Mizrahi-Meissonnier L, Griefner G, Erdinest I, Sharon D, Banin E. A homozygous frameshift mutation in BEST1 causes the classical form of Best disease in an autosomal recessive mode. Invest Ophthalmol Vis Sci. 2011;52:5332 - 8. [PubMed: 21467170]
- Boon CJ, Klevering BJ, den Hollander AI, Zonneveld MN, Theelen T, Cremers FP, Hoyng CB. Clinical and genetic heterogeneity in multifocal vitelliform dystrophy. Arch Ophthalmol. 2007;125:1100 - 6. [PubMed: 17698758]
- Boon CJ, Klevering BJ, Keunen JE, Hoyng CB, Theelen T. Fundus fluorescence imaging of retinal dystrophies. Vision Res. 2008;48:2569 - 77. [PubMed: 18289629]
- Burgess R, MacLaren RE, Davidson AE, Urquhart JE, Holder GE, Robson AG, Moore AT, Keefe RO, Black GC, Manson FD. ADVIRC is caused by distinct mutations in BEST1 that alter pre-mRNA splicing. J Med Genet. 2009;46:620 - 5. [PubMed: 18611979]
- Boon CJ, van den Born LI, Visser L, Keunen JE, Bergen AA, Booij JC, Riemslag FC, Florijn RJ, van Schooneveld MJ. Autosomal recessive bestrophinopathy: differential diagnosis and treatment options. Ophthalmology. 2013;120:809 - 20. [PubMed: 23290749]
- Burgess R, Millar ID, Leroy BP, Urquhart JE, Fearon IM, De Baere E, Brown PD, Robson AG, Wright GA, Kestelyn P, Holder GE, Webster AR, Manson FD, Black GC. Biallelic mutation of BEST1 causes a distinct retinopathy in humans. Am J Hum Genet. 2008;82:19 - 31. [PMC free article: PMC2253971] [PubMed: 18179881]
- Caldwell GM, Kakuk LE, Griesinger IB, Simpson SA, Nowak NJ, Small KW, Maumenee IH, Rosenfeld PJ, Sieving PA, Shows TB, Ayyagari R. Bestrophin gene mutations in patients with Best vitelliform macular dystrophy. Genomics. 1999;58:98 - 101. [PubMed: 10331951]
- Clemons TE, Milton RC, Klein R, Seddon JM, Ferris FL 3rd., Age-Related Eye Disease Study Research Group. Risk factors for the incidence of advanced age-related macular degeneration in the Age-Related Eye Disease Study (AREDS) AREDS report no. 19. Ophthalmology. 2005;112:533 - 9. [PMC free article: PMC1513667] [PubMed: 15808240]
- Eksandh L, Bakall B, Bauer B, Wadelius C, Andréasson S. Best's vitelliform macular dystrophy caused by a new mutation (Val89Ala) in the VMD2 gene. Ophthalmic Genet. 2001;22:107 - 15. [PubMed: 11449320]
- Fishman GA, Baca W, Alexander KR, Derlacki DJ, Glenn AM, Viana M. Visual acuity in patients with best vitelliform macular dystrophy. Ophthalmology. 1993;100:1665 - 70. [PubMed: 8233392]
- Glybina IV, Frank RN. Localization of multifocal electroretinogram abnormalities to the lesion site: findings in a family with Best disease. Arch Ophthalmol. 2006;124:1593 - 600. [PubMed: 17102007]
- Hartzell HC, Qu Z, Yu K, Xiao Q, Chien LT. Molecular physiology of bestrophins: multifunctional membrane proteins linked to best disease and other retinopathies. Physiol Rev. 2008;88:639 - 72. [PubMed: 18391176]
- Hayami M, Decock C, Brabant P, Van Kerckhoven W, Lafaut BA, De Laey JJ. Optical coherence tomography of adult-onset vitelliform dystrophy. Bull Soc Belge Ophtalmol. 2003;289:53 - 61. [PubMed: 14619630]
- Iannaccone A, Kerr NC, Kinnick TR, Calzada JI, Stone EM. Autosomal recessive best vitelliform macular dystrophy: report of a family and management of early-onset neovascular complications. Arch Ophthalmol. 2011;129:211 - 7. [PubMed: 21320969]
- Krämer F, Mohr N, Kellner U, Rudolph G, Weber BH. Ten novel mutations in VMD2 associated with Best macular dystrophy (BMD). Hum Mutat. 2003;22:418. [PubMed: 14517959]
- Krämer F, White K, Pauleikhoff D, Gehrig A, Passmore L, Rivera A, Rudolph G, Kellner U, Andrassi M, Lorenz B, Rohrschneider K, Blankenagel A, Jurklies B, Schilling H, Schütt F, Holz FG, Weber BH. Mutations in the VMD2 gene are associated with juvenile-onset vitelliform macular dystrophy (Best disease) and adult vitelliform macular dystrophy but not age-related macular degeneration. Eur J Hum Genet. 2000;8:286 - 92. [PubMed: 10854112]
- Leu J, Schrage NF, Degenring RF. Choroidal neovascularisation secondary to Best's disease in a 13-year-old boy treated by intravitreal bevacizumab. Graefes Arch Clin Exp Ophthalmol. 2007;245:1723 - 5. [PubMed: 17605026]
- Lotery AJ, Munier FL, Fishman GA, Weleber RG, Jacobson SG, Affatigato LM, Nichols BE, Schorderet DF, Sheffield VC, Stone EM. Allelic variation in the VMD2 gene in best disease and age-related macular degeneration. Invest Ophthalmol Vis Sci. 2000;41:1291 - 6. [PubMed: 10798642]
- Li Y, Wang G, Dong B, Sun X, Turner MJ, Kamaya S, Zhang K. A novel mutation of the VMD2 gene in a Chinese family with best vitelliform macular dystrophy. Ann Acad Med Singapore. 2006;35:408 - 10. [PubMed: 16865191]
- MacDonald IM, Gudiseva HV, Villanueva A, Greve M, Caruso R, Ayyagari R. Phenotype and genotype of patients with autosomal recessive bestrophinopathy. Ophthalmic Genet. 2012;33:123 - 9. [PubMed: 21809908]
- Marano F, Deutman AF, Leys A, Aandekerk AL. Hereditary retinal dystrophies and choroidal neovascularization. Graefes Arch Clin Exp Ophthalmol. 2000;238:760 - 4. [PubMed: 11045344]
- Marchant D, Yu K, Bigot K, Roche O, Germain A, Bonneau D, Drouin-Garraud V, Schorderet DF, Munier F, Schmidt D, Le Neindre P, Marsac C, Menasche M, Dufier JL, Fischmeister R, Hartzell C, Abitbol M. New VMD2 gene mutations identified in patients affected by Best vitelliform macular dystrophy. J Med Genet. 2007;44:e70. [PMC free article: PMC2598027] [PubMed: 17287362]
- Marmorstein AD, Marmorstein LY, Rayborn M, Wang X, Hollyfield JG, Petrukhin K. Bestrophin, the product of the Best vitelliform macular dystrophy gene (VMD2), localizes to the basolateral plasma membrane of the retinal pigment epithelium. Proc Natl Acad Sci U S A. 2000;97:12758 - 63. [PMC free article: PMC18837] [PubMed: 11050159]
- Marmorstein LY, McLaughlin PJ, Stanton JB, Yan L, Crabb JW, Marmorstein AD. Bestrophin interacts physically and functionally with protein phosphatase 2A. J Biol Chem. 2002;277:30591 - 7. [PubMed: 12058047]
- Marquardt A, Stöhr H, Passmore LA, Krämer F, Rivera A, Weber BH. Mutations in a novel gene, VMD2, encoding a protein of unknown properties cause juvenile-onset vitelliform macular dystrophy (Best's disease). Hum Mol Genet. 1998;7:1517 - 25. [PubMed: 9700209]
- Miller SA, Bresnick GH, Chandra SR. Choroidal neovascular membrane in Best's vitelliform macular dystrophy. Am J Ophthalmol. 1976;82:252 - 5. [PubMed: 949077]
- Mohler CW, Fine SL. Long-term evaluation of patients with Best's vitelliform dystrophy. Ophthalmology. 1981;88:688 - 92. [PubMed: 7267039]
- Mullins RF, Oh KT, Heffron E, Hageman GS, Stone EM. Late development of vitelliform lesions and flecks in a patient with best disease: clinicopathologic correlation. Arch Ophthalmol. 2005;123:1588 - 94. [PubMed: 16286623]
- Palmowski AM, Allgayer R, Heinemann-Vernaleken B, Scherer V, Ruprecht KW. Detection of retinal dysfunction in vitelliform macular dystrophy using the multifocal ERG (MF-ERG). Doc Ophthalmol. 2003;106:145 - 52. [PubMed: 12678279]
- Palomba G, Rozzo C, Angius A, Pierrottet CO, Orzalesi N, Pirastu M. A novel spontaneous missense mutation in VMD2 gene is a cause of a best macular dystrophy sporadic case. Am J Ophthalmol. 2000;129:260 - 2. [PubMed: 10682987]
- Patel N, Adewoyin T, Chong NV. Age-related macular degeneration: a perspective on genetic studies. Eye. 2008;22:768 - 76. [PubMed: 17491602]
- Petrukhin K, Koisti MJ, Bakall B, Li W, Xie G, Marknell T, Sandgren O, Forsman K, Holmgren G, Andreasson S, Vujic M, Bergen AA, McGarty-Dugan V, Figueroa D, Austin CP, Metzker ML, Caskey CT, Wadelius C. Identification of the gene responsible for Best macular dystrophy. Nat Genet. 1998;19:241 - 7. [PubMed: 9662395]
- Pianta MJ, Aleman TS, Cideciyan AV, Sunness JS, Li Y, Campochiaro BA, Campochiaro PA, Zack DJ, Stone EM, Jacobson SG. In vivo micropathology of Best macular dystrophy with optical coherence tomography. Exp Eye Res. 2003;76:203 - 11. [PubMed: 12565808]
- Qu Z, Chien LT, Cui Y, Hartzell HC. The anion-selective pore of the bestrophins, a family of chloride channels associated with retinal degeneration. J Neurosci. 2006;26:5411 - 9. [PubMed: 16707793]
- Querques G, Regenbogen M, Quijano C, Delphin N, Soubrane G, Souied EH. High-definition optical coherence tomography features in vitelliform macular dystrophy. Am J Ophthalmol. 2008;146:501 - 7. [PubMed: 18619572]
- Querques G, Zerbib J, Santacroce R, Margaglione M, Delphin N, Rozet JM, Kaplan J, Martinelli D, Delle Noci N, Soubrane G, Souied EH. Functional and clinical data of Best vitelliform macular dystrophy patients with mutations in the BEST1 gene. Mol Vis. 2009;15:2960 - 72. [PMC free article: PMC2802291] [PubMed: 20057903]
- Ramsden SC, Davidson AE, Leroy BP, Moore AT, Webster AR, Black GTCM, Manson FDC. Clinical utility gene card for: BEST1-related dystrophies (Bestrophinopathies) Eur J Hum Genet. 2012;20(5) [PMC free article: PMC3330226] [PubMed: 22234150]
- Renner AB, Tillack H, Kraus H, Kohl S, Wissinger B, Mohr N, Weber BH, Kellner U, Foerster MH. Morphology and functional characteristics in adult vitelliform macular dystrophy. Retina. 2004;24:929 - 39. [PubMed: 15579992]
- Rudolph G, Kalpadakis P. Topographic mapping of retinal function with the SLO-mfERG under simultaneous control of fixation in Best's disease. Ophthalmologica. 2003;217:154 - 9. [PubMed: 12592056]
- Schatz P, Klar J, Andréasson S, Ponjavic V, Dahl N. Variant phenotype of Best vitelliform macular dystrophy associated with compound heterozygous mutations in VMD2. Ophthalmic Genet. 2006;27:51 - 6. [PubMed: 16754206]
- Scholl HP, Schuster AM, Vonthein R, Zrenner E. Mapping of retinal function in Best macular dystrophy using multifocal electroretinography. Vision Res. 2002;42:1053 - 61. [PubMed: 11934455]
- Seddon JM, Afshari MA, Sharma S, Bernstein PS, Chong S, Hutchinson A, Petrukhin K, Allikmets R. Assessment of mutations in the Best macular dystrophy (VMD2) gene in patients with adult-onset foveomacular vitelliform dystrophy, age-related maculopathy, and bull's-eye maculopathy. Ophthalmology. 2001;108:2060 - 7. [PubMed: 11713080]
- Sun H, Tsunenari T, Yau KW, Nathans J. The vitelliform macular dystrophy protein defines a new family of chloride channels. Proc Natl Acad Sci U S A. 2002;99:4008 - 13. [PMC free article: PMC122639] [PubMed: 11904445]
- Testa F, Rossi S, Passerini I, Sodi A, Di Iorio V, Interlandi E, Della Corte M, Menchini U, Rinaldi E, Torricelli F, Simonelli F. A normal electro-oculography in a family affected by best disease with a novel spontaneous mutation of the BEST1 gene. Br J Ophthalmol. 2008;92:1467 - 70. [PubMed: 18703557]
- White K, Marquardt A, Weber BH. VMD2 mutations in vitelliform macular dystrophy (Best disease) and other maculopathies. Hum Mutat. 2000;15:301 - 8. [PubMed: 10737974]
- Yardley J, Leroy BP, Hart-Holden N, Lafaut BA, Loeys B, Messiaen LM, Perveen R, Reddy MA, Bhattacharya SS, Traboulsi E, Baralle D, De Laey JJ, Puech B, Kestelyn P, Moore AT, Manson FD, Black GC. Mutations of VMD2 splicing regulators cause nanophthalmos and autosomal dominant vitreoretinochoroidopathy (ADVIRC). Invest Ophthalmol Vis Sci. 2004;45:3683 - 9. [PubMed: 15452077]
- Yu K, Cui Y, Hartzell HC. The bestrophin mutation A243V, linked to adult-onset vitelliform macular dystrophy, impairs its chloride channel function. Invest Ophthalmol Vis Sci. 2006;47:4956 - 61. [PubMed: 17065513]
- Yu K, Qu Z, Cui Y, Hartzell HC. Chloride channel activity of bestrophin mutants associated with mild or late-onset macular degeneration. Invest Ophthalmol Vis Sci. 2007;48:4694 - 705. [PubMed: 17898294]
- Yu K, Xiao Q, Cui G, Lee A, Hartzell HC. The Best disease-linked Cl- channel hBest1 regulates Ca V 1 (L-type) Ca2+ channels via src-homology-binding domains. J Neurosci. 2008;28:5660 - 70. [PMC free article: PMC2587081] [PubMed: 18509027]
- Zhao L, Grob S, Corey R, Krupa M, Luo J, Du H, Lee C, Hughes G, Lee J, Quach J, Zhu J, Shaw PX, Kozak I, Zhang K. A novel compound heterozygous mutation in the BEST1 gene causes autosomal recessive Best vitelliform macular dystrophy. Eye (Lond) 2012;26:866 - 71. [PMC free article: PMC3376281] [PubMed: 22422030]
- Zhuk SA, Edwards AO. Peripherin/RDS and VMD2 mutations in macular dystrophies with adult-onset vitelliform lesion. Mol Vis. 2006;12:811 - 5. [PubMed: 16885924]
章节注释
Author History
Thomas Lee, MD (2003-present)
Ian M MacDonald, MD, CM (2003-present)
Dean Y Mah, MSc, MD; University of Alberta (2003-2009)
Revision History
- 12 December 2013 (me) Comprehensive update posted live
- 7 April 2009 (me) Comprehensive update posted live
- 8 December 2005 (me) Comprehensive update posted to live Web site
- 27 October 2003 (imd) Revision: 序列分析 clinically available
- 30 September 2003 (me) Review posted to live Web site
- 14 July 2003 (imd) Original submission
