概述
临床特点。
乳糜泻是一种全身性自身免疫疾病,表现为胃肠道症状(腹泻、体重减轻、腹痛、厌食、乳糖不耐症、腹胀和肠易激)和/或程度差异很大的非胃肠道症状(缺铁性贫血、疱疹样皮炎、慢性疲劳、关节疼痛/发炎、偏头痛、抑郁症、注意力障碍、癫痫症、骨质疏松症/骨质减少、不育和/或反复流产、维生素缺乏症、身材矮小、发育停滞、青春期延迟、牙釉质缺陷和自身免疫性疾病)。没有胃肠道症状的非经典型乳糜泻比存在轻到重度胃肠道症状的经典型乳糜泻更为常见。
诊断/检测。
乳糜泻的诊断依赖于小肠活检组织的特征性表现以及无麸质饮食对临床症状和/或组织学表现的改善效果。大多数乳糜泻患者都有与之相关的抗体;存在人类白细胞抗原(HLA)II类基因HLA-DQA1和HLA-DQB1的特定等位基因变异是发生乳糜泻的必要条件。总人口中有30%携带一种或多种与乳糜泻相关的等位基因变异,然而只有其中的3%罹患乳糜泻,因此携带乳糜泻相关HLA等位基因不能诊断乳糜泻,而不携带者则可基本排除诊断。
治疗。
对症治疗:终身坚持严格无麸质饮食(避免小麦、黑麦和大麦);治疗营养缺乏症(铁、锌、钙、脂溶性维生素、叶酸);正规治疗骨质疏松症。
主要表现的预防:终身无麸质饮食。
监测: 对于无麸质饮食治疗有效的有症状患者,定期进行体格检查并评估其生长、营养状况和非胃肠道表现;诊断后1-3年再次小肠活检。对于无麸质饮食治疗无效的有症状患者,应定期监测难治性乳糜泻、溃疡性肠炎、T细胞淋巴瘤和其他胃肠道癌症的发生。
要避免的药物/环境: 饮食中的麸质。
风险亲属评估:先证者的一级亲属(包括幼儿)应进行分子遗传学检测确定其是否携带已知的乳糜泻易感等位基因以便早期获得乳糜泻证据从而在疾病早期指导建立无麸质饮食。
遗传咨询。
乳糜泻是由已知与其易感性有关的HLA-DQA1和HLA-DQB1等位基因变异和非HLA基因中未获公认变异、麦胶蛋白/醇溶蛋白(麸质中的一个成分)以及其他环境因素相互作用共同导致的多因素疾病。某些高危亲属的经验性风险数据目前可用。
诊断
乳糜泻的确诊需通过在患者保持含麸质饮食状态时对其上消化道内镜检查过程中的十二指肠活检组织学特征性改变 (表1) 的识别来确认[Lebwohl et al 2012]。
十二指肠活检的适应症包括:
- 提示乳糜泻的血清学结果,最常见的是抗组织转谷氨酰胺酶(TTG)IgA抗体升高(参见无麸质饮食的有症状个体检测策略乳糜泻特异性抗体检测。)
- 任何内镜检查中的常规指征 [Green & Jabri 2003]
- 在血清学检查阴性(灵敏度尚不完美)情况下仍有高度可能性罹患乳糜泻 [Rubio-Tapia et al 2013]
其他可用的诊断方法包括:
- 欧洲儿科胃肠病学、肝病学和营养学会最近发布的指南 [Husby et al 2012] 允许在以下特定情况下,不进行十二指肠活检而诊断乳糜泻: TTG IgA(>正常上限的10倍),两次血检显示抗肌内膜抗体水平升高,以及与乳糜泻(DQ2或DQ8)一致的HLA单倍型。 这些新准则考虑到,在这些高概率罹患乳糜泻的情况下,父母可能希望孩子避免上消化道内镜检查。
注意:这些指南目前存在一些争议,且目前在美国没有任何指南推荐在不进行活检的情况下进行乳糜泻诊断。 - “五分之四规则”(Catassi & Fasano [2010]提出,Sapone et al [2012]描述)建议,如果存在以下五个特征中的四个,可以诊断乳糜泻:
1.乳糜泻的典型症状
2.高滴度的乳糜泻抗体
3.共存的HLA单倍型(DQ2或DQ8)
4.小肠活检发现病变
5.对无麸质饮食的反应
官方指南尚未正式认可“五分之四规则”,目前,诊断乳糜泻的标准要求在任何情况下都需要十二指肠活检,可能的例外是欧洲指南建议的有症状的儿童。
Hill & Rakitt [2014]和Guandalini & Assiri [2014]提供了乳糜泻诊断的其他概述。Oxentenko & Murray [2015]总结了十项关键的诊断和治疗建议。
确立乳糜泻诊断的检测策略
下列检测策略基于乳糜泻诊疗中心的临床实践和文献综述。
I对于采取无麸质饮食前存在症状的患者
注意:有关症状的描述,请参见临床特征。
特定的乳糜泻相关抗体检测。Leffler & Schuppan [2010] 综述了乳糜泻相关抗体的检测。 最有用的单一抗体检测是组织转谷氨酰胺酶(tTG)IgA。使用多种抗体检测可提高乳糜泻血清学检测的敏感性和特异性。重要的是,在与乳糜泻相关抗体检测同时检测总IgA,从而排除IgA缺乏症。
- 组织转谷氨酰胺酶(tTG)IgA。 组织转谷氨酰胺酶(tTG)免疫球蛋白A(IgA)血清浓度测量通常推荐用于初始测试,因为它针对乳糜泻的敏感性和特异性都很高且成本相对较低,此外还具有检测方便、可靠性好的优点 [Leffler & Schuppan 2010]。这是一种针对肠道蛋白质的抗体,它的产生是乳糜泻自身免疫过程的结果。
- 抗脱酰胺麦醇溶蛋白相关肽(a-DGP)抗体IgA和IgG。该检测的对象是与合成的脱酰胺麦醇溶蛋白相关肽(DGP)结合的抗体。在针对乳糜泻高发人群的初步研究中,两种亚型(IgA和IgG)均显示出对活动性乳糜泻的高度敏感性和特异性 [Vermeersch et al 2010]。在幼儿中,DGP抗体水平的升高可能先于血清tTG-IgA浓度的升高 [Liu et al 2007]。然而就像所有的抗体检测一样,少数假阴性结果仍然存在。
- 肌内膜抗体(EMA)IgA。血清中EMA-IgA浓度具有最高的特异性(~99%),但是较之tTG-IgA检测,其花费更贵、耗时更长、并且更容易产生假阴性结果。由于通过间接免疫荧光测定,EMA-IgA血清浓度结果存在一定主观性,从而影响其敏感性。当在经验丰富的实验室中进行时,该检测具有比tTG抗体检测更高的特异性(接近100%),可用于肝硬化患者。
- 测量总IgA血清浓度以评估选择性IgA缺乏症。选择性IgA缺乏症的病因不明,在一般人群中的患病率为1:700。 出于未知的原因,乳糜泻患者中选择性IgA缺乏症的患病率高于一般人群(1:50)。
由于罹患选择性IgA缺乏症的个体不会产生IgA抗体,因此这些个体中不存在与乳糜泻相关的IgA抗体tTG-IgA和EMA-IgA。所以应该在这些个体中进行乳糜泻相关IgG抗体(tTG-IgG或DGP-IgG)的检测。
需注意,由于特异性相对较差,目前不再推荐使用第一代抗醇溶蛋白抗体 (AGA) 。对于选择性IgA缺乏患者,应检测抗TTG和DGP的IgG抗体。检测结果为阳性或不确定时应进行小肠活检。
如果临床高度怀疑乳糜泻或存在明显的吸收不良,则不论乳糜泻相关抗体检测结果如何军应进行小肠活检。
小肠活检。组织学特征性表现是诊断乳糜泻的金标准,包括部分或完全绒毛萎缩、隐窝增生和上皮内淋巴细胞(IEL)升高。基于乳糜泻中小肠病变模式的动态发展和轻度病变的发生频率,Marsh [1992] 提出了一个四阶段的分级法用以建立诊断并评估对无麸质饮食的反应 (表 1)。
饮食中去除麸质后肠损伤恢复是乳糜泻的独特表现,其余变化均不是乳糜泻所独有的。
活检的阳性预测值取决于乳糜泻在人群中相对于其他肠道疾病的患病率。
表1. 乳糜泻的肠道病损分类
| 类型 | 粘膜表现 |
|---|---|
| 0期 浸润前期 | 正常 |
| 1期 浸润性病变 1 | 上皮内淋巴细胞增加 |
| 2期 增生性病变 | 1期病变+隐窝增生 |
| 3期 破坏性病变 2 | 2期病变以及下述情况:
|
| 4期 发育不良病变 3 | 完全绒毛萎缩伴隐窝发育不良 |
- 1.
1期病变也可能见于其他疾病,例如炎症性肠病(IBD)、使用非甾体抗炎药(NSAIDs)、Sjögren综合征、幽门螺杆菌胃炎以及其他食物不耐受。
- 2.
3期是典型的乳糜泻病变和最常见的活检结果,在其他疾病中也可见到,包括热带性腹泻、小肠细菌过度生长、使用NSAIDS、急性胃肠炎和自限性肠炎。
- 3.
4期偶见于老年人。
小肠活检可能无法在下述情况中检测到乳糜泻的组织学变化:
- 应用无麸质饮食
- 疾病早期阶段
- 黏膜斑块状病变
- 消化性疾病掩盖乳糜泻病变
- 活检取样数量不足
- 显微镜分析中载玻片的方向不正确
- 潜在性乳糜泻(乳糜泻相关抗体检测阳性,但小肠活检无绒毛萎缩) [Alaedini & Green 2005, Hill et al 2005]
对定向性较差的对取样位置不佳活检结果的过度解释也可能导致乳糜泻假阳性。
鉴于乳糜泻组织病理特征的不均一性,指南建议进行4-6处十二指肠活检对病情加以评估 [Green & Cellier 2007, Lebwohl et al 2011]。该指南在美国的依从性很低,因此有必要增加建议活检数量 [Lebwohl et al 2011]。
- 如果在未检出乳糜泻相关抗体的情况下仍然疑似诊断,则针对乳糜泻相关HLA等位基因的分子遗传学检测可以帮助排除或确定乳糜泻易感性。(请参见接受无麸质饮食仍有症状个体的分子遗传学测试)
- 乳糜泻明确诊断建立的条件包括小肠活检发现典型组织学改变以及接受无麸质饮食后发生临床和/或组织学改善。但是,在自限性肠炎和热带性腹泻患者中存在例外,他们的症状也会因无麸质饮食而有所改善。
接受无麸质饮食仍有症状个体
乳糜泻特异性抗体检测对接受无麸质饮食患者是不适用的,因为接受无麸质饮食后这些抗体通常都会消失。此时如果需要乳糜泻的诊断,则可以在进行乳糜泻血清学检测和小肠活检之前接受麸质刺激试验(接受含麸质饮食至少两周)以确认诊断。
如果患者担心疾病风险和肠道损害而不愿接受麸质刺激实验,则不能进行乳糜泻明确诊断。患者放弃确诊,并可在症状得到缓解的情况下继续无麸质饮食。这种情况下,分子遗传学检测可以提供有关乳糜泻易感性的信息。
乳糜泻相关性HLA等位基因分子遗传学检测的结果为阴性时可以排除诊断,为阳性是可以确定诊断。
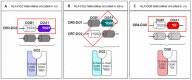
存在人类白细胞抗原 (HLA) II类基因HLA-DQA1和HLA-DQB1的特定变异是发生乳糜泻的必要条件。这两个基因共同编码乳糜泻相关异二聚体蛋白DQ2和DQ8的α和β链 [Sollid 2002; Guandalini等2014综述] (见图1)。
使用下列任一方法均可确定HLA-DQA1和HLA-DQB1基因型从而检测是否存在与乳糜泻相关的等位基因。如果出现任何以下结果则受检者具有乳糜泻易感性:
- DQ2阳性 (HLA-DQA1*0501或*0505且HLA-DQB1*0201或*0202)
- DQ2半阳性 (HLA-DQA1*0501或*0505或HLA-DQB1*0201或*0202)
- DQ8阳性 (HLA-DQA1*03且HLA-DQB1*0302)
存在这些HLA等位基因是发生乳糜泻的必要条件,但不是充分条件。
- DQ2蛋白存在于超过90%的乳糜泻患者和20%-30%的普通人群 [Sollid & Lie 2005]。
- 少部分乳糜泻患者只有HLA-DQA1基因变异(*0501或*0505) 或HLA-DQB1基因变异 (*0201 or *0202)中的一个而非全部(即仅为DQ2异二聚体半阳性)。
- DQ8蛋白存在于5%-10%乳糜泻患者和大约10%的普通人群 [Sollid & Lie 2005]。
分子遗传学检测结果解读。 因为总人口中至少一个乳糜泻相关HLA等位基因(编码异二聚体DQ2蛋白和/或DQ8蛋白)的携带率高达30%,而只有3%的携带者会罹患乳糜泻,所以乳糜泻相关HLA等位基因检测结果不能用来诊断乳糜泻。
注意:抗体检测和小肠活检的可靠性取决于饮食中是否含有麸质,与之不同,乳糜泻相关的HLA等位基因的分子遗传学检测结果可以进行独立于饮食的准确判读 [Alaedini & Green 2005]。
- 缺乏任何乳糜泻相关HLA等位基因 (见表3) 可基本上排除乳糜泻的诊断 [Sollid & Lie 2005]。
表3. 不同HLA-DQ2和/或DQ8基因型的遗传风险
| HLA DQ2/DQ8基因型 1 | 风险 1 |
|---|---|
| DQ2+DQ8 | 1:7 (14.3%) |
| DQ2+DQ2 或 DQ2 纯合DQB1*02 | 1:10 (10%) |
| DQ8+DQ8 2 | 1:12 (8.4%) 2 |
| DQ8+DQB1*02 | 1:24 (4.2%) |
| 纯合DQB1*02 | 1:26 (3.8%) |
| 仅有DQ2 | 1:35 (2.9%) |
| 仅有DQ8 | 1:89 (1.1%) |
| 人群风险 | 1:100 (1%) |
| ½ DQ2: DQB1*02 | 1:210 (0.5%) |
| ½ DQ2: DQA1*05 | 1:1842 (0.05%) |
| 无HLA-DQA/DQB乳糜泻易感等位基因 | 1:2518 (<0.04%) |
- 1.
除DQ8+DQ8以外的所有基因型摘自Megiorni等 [2009]
- 2.
乳糜泻相关抗体检测结果不明确的有症状个体
如果从前未行检测,则应进行tTG、EMA、DGP的IgA和IgG以及总IgA全套检测。
对于乳糜泻相关抗体检测结果仍不明确的个体,建议进行乳糜泻相关HLA等位基因分子遗传学检测以排除或确定其HLA对乳糜泻的易感性 (请参见接受无麸质饮食仍有症状个体的分子遗传学测试)。
对于携带乳糜泻相关HLA等位基因且在接受含麸质饮食(即每天2片面包持续2周以上)情况下临床高度疑似者,建议进行小肠活检。
乳糜泻的明确诊断基于小肠活检阳性且接受无麸质饮食后的临床症状和/或组织学改善。
小肠活检结果结果不明确的有症状个体
病理切片应由胃肠病理专家进行检查。
乳糜泻相关HLA等位基因分子遗传学检测同样具有价值 (请参见接受无麸质饮食仍有症状个体的分子遗传学测试)。对于携带乳糜泻相关HLA等位基因的个体,应重复进行乳糜泻相关抗体检测 (TTG和/或DGP/EMA),如有必要还应继续进行小肠活检。
对于乳糜泻相关抗体检测结果阴性 (即TTG和/或DGP/EMA) 个体无论其是否携带乳糜泻相关HLA等位基因,都需要调查导致症状的其他可能原因 (请参阅鉴别诊断)。
对无麸质饮食没有反应的有症状个体
注意:采用无麸质饮食后症状人持续存在者不太可能患有乳糜泻。
建议在开始无麸质饮食之前检查乳糜泻相关抗体检测的原始结果(如果完成),并由胃肠病理专家检查原始活检结果(如果完成)以确认乳糜泻的诊断。如果结果为阴性或不确定,建议采取以下措施:
- 进行乳糜泻相关HLA等位基因的分子遗传学检测以确定其易感类型 (请参见接受无麸质饮食仍有症状个体的分子遗传学测试)。
- 调查乳糜泻以外其他引起类似症状的原因 (请参阅鉴别诊断)。
- 向专家营养师咨询饮食中的潜在麸质并评估是否存在乳糖或果糖不耐受,这可能导致无麸质饮食的临床疗效不佳。
患有与乳糜泻相关疾病的个体
注意:相关疾病包括唐氏综合症、特纳综合症、选择性IgA缺乏症、自身免疫性疾病(胰岛素依赖型糖尿病,干燥综合征,甲状腺炎)。正如Guandalini [2004]所述,这些疾病患者中的乳糜泻患病率比普通人群更高 (请参见患病率)。
推荐进行乳糜泻特异性抗体检测。
乳糜泻相关HLA等位基因分子遗传学检测可以用来排除乳糜泻诊断,即不存在该等位基因可以排除诊断。(请参阅在接受无麸质饮食仍有症状个体的分子遗传学检测)
不孕女性
由于未诊断的乳糜泻是不孕症的危险因素,对于排除了其他病因的不育女性,可以考虑进行乳糜泻特异性抗体检测。无麸质饮食可能对女性乳糜泻患者的生育能力有积极影响。
临床特点
有关乳糜泻及其临床表现的深度述评,请参阅Green & Cellier [2007]和Guandalini & Assiri [2014]。
临床描述
乳糜泻曾被认为是胃肠道吸收不良性疾病,现已明确其实是一种具有胃肠道症状和多种高度可变的非胃肠道症状的全身性自身免疫性疾病 (见图2)。它是由饮食中麸质在遗传易感人群中诱发的。
乳糜泻可在断奶后的任何年龄发病。对于成年人,诊断的高峰年龄在30至50岁之间。
从症状出现到诊断的平均时间为11年,其原因在于乳糜泻与其他多种疾病共享着广泛的非特异性症状、高度可变的发病年龄以及某些患者缺乏症状(即沉默性乳糜泻)[Stavropoulos et al 2001]。发病到诊断时间范围也随对疾病的了解程度和患者的临床表现而异。
据报道,确诊乳糜泻的男女比例为3:1。
乳糜泻的临床表现
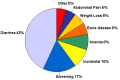
乳糜泻的特点是广泛的临床表型谱和症状在不同患者间的高度差异性。图2所示为一些重要表现的出现比例。
乳糜泻的表型特征包括但不限于以下方面:
- 胃肠道表现:慢性或复发性腹泻、吸收不良、腹痛、腹胀、呕吐和体重减轻。患者通常会被诊断为肠易激综合症(IBS) [Hill et al 2005]。多达50%的乳糜泻患者在诊断时并没有每日腹泻 [Rampertab et al 2006],另有许多患者是超重甚至是肥胖的 [Murray et al 2004]。
- 非胃肠道表现:疱疹样皮炎、慢性疲劳、关节痛/炎症、缺铁性贫血、偏头痛、抑郁症、注意力缺陷障碍、癫痫、骨质疏松症/骨质减少、不育和/或复发性胎儿流失、维生素缺乏症、身材矮小、生长发育落后、青春期延迟、牙釉质缺损、神经系统症状和各种继发性自身免疫性疾病 [Green & Jabri 2003, Hill et al 2005, NIH Consensus Committee 2005]。
乳糜泻分型
经典型乳糜泻:存在中到重度吸收不良症状如腹泻、生长发育落后和体重减轻 [Hill et al 2005]。经典型乳糜泻患儿通常在6-24月龄间出现症状 [Fasano & Catassi 2005]。
非经典型乳糜泻:没有图2所示明显胃肠道症状或吸收不良的乳糜泻;然而非典型性乳糜泻患者也可能具有其他胃肠道症状如胃食管反流、腹痛、腹胀、呕吐、便秘和消化不良,这导致其常被错误诊断为IBS。大约70%的患者是根据乳糜泻相关肠外表现而诊断的。
缺铁性贫血是非典型性乳糜泻的最常见表现且可能是唯一表现。
疱疹样皮炎是累及四肢伸面的严重瘙痒性皮疹,也是常见的非胃肠道表现。
其他肠外表现包括骨质疏松症/骨质减少、牙釉质发育不全、不育和/或复发性胎儿流失、维生素缺乏症、转氨酶升高、疲劳、精神病综合症以及各种神经系统疾病,包括周围神经病变、共济失调、癫痫发作、偏头痛、注意力缺陷多动障碍(ADHD)和学习成绩差。
非经典型乳糜泻通常出现在儿童后期或成年期。非经典型乳糜泻患儿可能出现无法解释的身材矮小、神经系统症状和青春期延迟。
非经典型乳糜泻比经典型乳糜泻更为普遍 [Ludvigsson at al 2013]。
沉默乳糜泻:缺乏症状,但在乳糜泻相关抗体检测阳性且小肠活检可见绒毛萎缩。沉默性乳糜泻患者的识别通常经由受累家庭成员或筛查项目实现 (见图3) [Fasano & Catassi 2005]。
隐性乳糜泻:乳糜泻血清学检测阳性且小肠活检结果正常。 如果继续摄入麸质,则部分患者随后会发生绒毛萎缩。
难治性腹泻/乳糜泻 (RCD):尽管严格无麸质饮食至少持续6-12个月,吸收不良症状仍然持续存在并伴有持续存在的肠道炎症和绒毛萎缩。所有难治性乳糜泻患者均大于20岁。文献中很少有特征明确的难治性乳糜泻患者的研究。尽管部分患者对皮质类固醇和免疫抑制剂有反应,但预后情况尚不明确:
- 原发难治性腹泻指从未对无麸质饮食产生反应的情况,也正因如此,分子遗传学检测在此类人群尤为重要且为主要诊断标准之一。
- 继发难治性腹泻指尽管在坚持无麸质饮食的情况下病情完全好转,随后却又复发的情况。
RCD的另一种分类依据是患者的上皮内淋巴细胞 (IEL)情况:
- 活跃-非复杂型乳糜泻,IEL细胞表面具有CD3和CD8分子,这是正常现象。 另外,这些淋巴细胞不受克隆限制(即多克隆)。
- RCD1,IEL正常。
- RCD2,IEL存在以下异常:
- 细胞表面失去CD3、CD8和TCR。
- 细胞内可检测到CD3。
- 通常为克隆性的。
RCD2比RCD1的预后更差,这是因为对免疫抑制反应不良以及进展为与肠病相关的T细胞淋巴瘤(EATL)的发生率较高,导致死亡率更高。难治性腹泻患者发生EATL的风险可能超过50% [Green & Jabri 2003]。
基因型-表现型相关性
遗传风险最高的结果是同时具有DQ2和DQ8。
在受累个体中,没有发现仅具有HLA-DQ2基因型者与仅具有HLA-DQ8基因型者在乳糜泻临床严重程度上存在差异。
具有DQ2且HLA-DQB1*02等位基因为纯合者比具有DQ2但仅有一个HLA-DQB1*02等位基因者罹患乳糜泻的风险更高 (表3)。
据报道,在经典型乳糜泻患者中,HLA-DQB1*02等位基因纯合子比在非经典型乳糜泻患者以及难治性腹泻和EATL等复杂病例中更为常见[Karinen et al 2006]。
仅具有一半DQ2分子者(即仅有HLA-DQA1序列变异[*0501或*0505]或HLA-DQB1序列变异[*0201或*0202])可能罹患乳糜泻,但其风险远低于拥有完整HLA-DQ2基因型者(即HLA-DQA1序列变异[*0501或*0505]和HLA-DQB1序列变异[*0201或*0202]) [Zubillaga et al 2002, Margaritte-Jeannin et al 2004]。
外显率
乳糜泻的外显率较低。携带乳糜泻相关HLA等位基因基因型个体中约有3%发生乳糜泻。请参见接受无麸质饮食仍有症状者的检测策略、分子遗传检测以及图3。另参见遗传咨询查看有关家庭成员风险的详细信息。
其他遗传因素对HLA-DQ2或HLA-DQ8基因型个体的乳糜泻外显率的影响显然存在,正如乳糜泻的家族聚集现象所证明的那样。从理论上讲,以下因素会影响外显率:
- 肠通透性。与非患者相比,乳糜泻患者的肠通透性增加,可能允许更多的麦醇溶蛋白肽进入粘膜下层。紧密连接调节蛋白Zonulin在乳糜泻患者受到麦醇溶蛋白的刺激而持续上调,导致细胞旁通透性增加,而这种作用在非患者中是有限且短暂的 [Fasano 2011]。
- 对麦醇溶蛋白的先天免疫反应。不同于HLA相关免疫应答的对麦醇溶蛋白的先天免疫应答的遗传差异似乎参与了某些患者乳糜泻和绒毛萎缩的发生。
流行情况(患病率)
Guandalini等[2014] 综述了乳糜泻的流行病学信息。
乳糜泻曾被认为是一种罕见疾病,现已明确其会影响大约1%的美国人,然而2012年的一项全国调查估计只有17%的乳糜泻患者获得诊断 [Rubio-Tapia et al 2012]。如爱尔兰和芬兰研究所证明的,给医生提供有关乳糜泻可变临床表现以及在诊断中使用乳糜泻相关抗体检测可以提高诊断率。在芬兰的某些地区,占普通人群1%的乳糜泻患者中的多达70%已获得诊断 [Collin et al 2007]。
一项美国研究显示在没有已知危险因素的组中,乳糜泻总体患病率为1/133 (0.8%),相比而言在先证者的一级亲属则为1/22、二级亲属为1/39、有胃肠道症状或乳糜泻相关胃肠外疾病的个体中为1/56 [Fasano et al 2003]。
Hoffenberg等[2003]使用tTG IgA检测发现科罗拉多州丹佛市5岁儿童的乳糜泻患病率为1/104。
乳糜泻在欧洲、美国、澳大利亚、墨西哥和一些南美国家很普遍,印度西北部也有报道。据报道,乳糜泻患病率的最高值为5.6%,是在一个北非难民群体中检出的。
尽管有非裔加勒比人和非裔美国人患病的报道,但在撒哈拉以南非裔人中十分罕见。在这些人群和其他少数族裔人群中的漏诊率可能很高。
乳糜泻在下列疾病中的患病率增加 [Fasano et al 2003, Hoffenberg et al 2003, Treem 2004, Green 2005, NIH共识委员会2005]:
- 唐氏综合症 (乳糜泻的患病率: 5%-12%)
- 特纳综合征 (~3%)
- 威廉姆斯综合征 (3%-10%)
- 选择性IgA缺乏症 (~2%-10%)
- 自身免疫性疾病包括:
- 胰岛素依赖型糖尿病 (~6%)
- 干燥综合征 (~5%)
- 甲状腺炎 (~2%-4%)
难治性腹泻的患病率尚不清楚,极可能十分罕见。
遗传(等位基因)相关疾病
与乳糜泻相关HLA等位基因相关的描述仅见于这种表型宽泛且可变的乳糜泻及其相关疾病、继发性自身免疫病,除此之外未见于其他疾病 (参见患病率)。
鉴别诊断
乳糜泻的漏诊广泛存在,因为其症状可变、通常隐匿且临床表现与许多其他疾病存在重叠。
容易掩盖或混淆乳糜泻诊断的疾病包括消化不良、IBS、炎性肠病(IBD)、热带口炎性腹泻、便秘、慢性疲劳和各种神经系统综合症 [Alaedini & Green 2005, NIH Consensus Committee 2005]。其中一些疾病可能与乳糜泻同时发生。
据估计,36%的乳糜泻患者最初被诊断为IBS [Stavropoulos et al 2001]。大约5%的IBS患者和2%的IBD患者同时也患有乳糜泻 [Sanders et al 2001, Yang et al 2005]。
乳糜泻以外的麸质敏感病因。接受无麸质饮食并从中受益的人数大大超出了乳糜泻患者的预期人数,这一现象已越来越明显。在新版的麸质相关疾病命名与分类共识 (Sapone et al [2012]综述) 中,根据发病机理不同确定的三类麸质相关疾病分别为:
自身免疫性(乳糜泻、疱疹样皮炎和麸质共济失调)
过敏性(小麦过敏)
非自身免疫或过敏性的免疫介导疾病(非乳糜泻或过敏性麸质敏感症)
小麦过敏症是针对小麦蛋白质的一种免疫性(过敏)不良反应,其特征为抗小麦IgE抗体的产生。小麦过敏分为:
- 经典食物过敏
- 小麦依赖的运动诱发过敏反应(WDEIA)
- 职业性哮喘(面包师哮喘)和鼻炎
- 接触性荨麻疹
Levy & Levy-Carrick [2014]对小麦过敏症进行了综述。
皮肤点刺试验、体外IgE实验和食物刺激是小麦过敏症的诊断方法。
据报道,小麦和/或麸质过敏症在美国的患病率为0.4%。
虽与乳糜泻不同,非乳糜泻或过敏性麸质敏感症也涉及麸质敏感性,并可从无麸质饮食中获益。非乳糜泻麸质敏感症患者对麸质不耐受,但没有乳糜泻的组织学改变(如小肠活检特征表现)或乳糜泻特异性抗体(如tTG或EMA IgA)水平升高 [Sapone et al 2012, Catassi et al 2014]。尽管有些抗麦醇溶蛋白IgA抗体 (AGA) 升高,但没有非乳糜泻或过敏性麸质敏感症特异性的诊断标记物。接受无麸质饮食后症状改善并排除乳糜泻及小麦过敏症则可诊断本疾病。
非乳糜泻麸质敏感症可表现出与乳糜泻相似的肠道症状(包括IBS)和肠外症状 [Sapone et al 2011]。具有神经系统或胃肠道症状但不符合乳糜泻诊断却又对无麸质饮食表现出疗效的患者,临床上对这样的病人难以评价,可能将其称为“麸质敏感症”或“麸质不耐受”。
乳糜泻和非乳糜泻麸质敏感症对麸质的病理反应有所不同:乳糜泻是由适应性免疫反应引起的,而非乳糜泻麸质敏感症被认为是由先天免疫反应引起的[Sapone et al 2011]。据估计,每诊断1名乳糜泻患者便意味着同时存在6-7名非乳糜泻麸质敏感症患者的存在。
治疗
初诊后评估
建议乳糜泻患者进行以下检查以评估疾病严重程度:
- 接受含麸质饮食患者进行小肠活检以评估绒毛萎缩程度 (表1)。 但绒毛萎缩程度与临床表现严重程度无关
- 成年人进行基线骨密度检测以评估骨质疏松症/骨质减少症程度。 骨质疏松症患者应评估维生素D和甲状旁腺激素的浓度[Green & Jabri 2003]
- 筛查贫血、肝功能异常和营养缺乏症(铁、钙、维生素D、维生素B12、叶酸)
- 对有症状和/或老年患者评估合并恶性肿瘤或自身免疫性疾病 [Alaedini & Green 2005, Pietzak 2005]
对症治疗
乳糜泻。理想情况下,对新诊断患者的治疗应该由包括胃肠专科医生、初级保健医生和资深营养师在内的团队共同提供 (见图4)。国家支持组织的当地分支机构可以作为额外资源提供帮助 [NIH共识委员会2005] (见图4)。
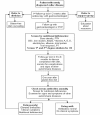
图4.
新诊断乳糜泻患者治疗流程 [Pietzak 2005] 经MM Pietzak博士允许摘录
乳糜泻患者的唯一治疗方法是严格遵守无麸质饮食,需要终生避免小麦、黑麦和大麦:
- 无麸质饮食治疗必须在小肠活检明确诊断后才开始。
- 具有治疗乳糜泻经验的营养师必须参与其中。
- 大约70%的受累患者在开始无麸质饮食后两周内症状开始改善。
- 对于某些患者,即使少量麸质(即100毫克)也可能损害小肠。 一片面包所含麸质约为2.5克。
- 由于麸质存在于多种食品和其他摄入物质之中,所以坚持无麸质饮食可能很困难。 一些隐匿的麸质来源如下:
- 非淀粉类食品,比如酱油和啤酒
- 非食品类,比如一些药物和化妆品(例如唇膏)
- 营养缺乏和代谢性骨病应按常规方法治疗。
“无反应性乳糜泻”:无麸质饮食不能带来改善的情况:
- 无反应性乳糜泻最常见原因是饮食中存在少量麸质。这种麸质摄入可能是有意的(例如在社交活动中“作弊”或食用圣餐饼),也可能是无意的(包括摄入药物中所含麸质和食用酒店中的含麸质食物)。建议从具有无麸质饮食管理经验的营养师那里获得建议以取得最佳治疗效果。
- 如果麸质污染并不是患者无麸质饮食治疗无效的原因,则有必要评估其他诊断的可能性如微观结肠炎、胰腺外分泌功能不全、IBS、小肠细菌过度生长和进食障碍。
对无麸质饮食治疗无效患者进行乳糜泻易感性HLA单倍型检测可以提供继续当前饮食治疗方案的依据、检查饮食中是否含有隐藏的麸质来源、判断为难治性腹泻的可能性、甚至可能推翻先前的乳糜泻诊断。
难治性腹泻或乳糜泻。坚持无麸质饮食但仍症状和肠道炎症仍持续存在的患者可能需要使用系统性皮质类固醇(例如局部活性的布地奈德)和免疫抑制剂治疗 [Green & Jabri 2003, NIH共识委员会 2005]。
主要表现的预防
参见对症治疗。
母乳喂养被认为对幼儿期乳糜泻具有保护作用,但最近两项临床试验并未得到此类结果 [Lionetti et al 2014, Vriezinga et al 2014]。
较早进行的比较母乳喂养儿与非母乳喂养儿的研究发现,后来患上乳糜泻的母乳喂养儿可能具有如下情况:
- 症状出现较晚;
- 典型症状较少,例如腹泻、生长障碍、呕吐、腹痛或腹胀 [Ivarsson et al 2002];
- “非经典”症状比例较高 [D'Amico et al 2005]。
并发症的预防
无麸质饮食可以治疗下述情况:
- 逆转乳糜泻患儿的生长发育迟缓和骨矿化减少;
- 降低乳糜泻妇女患者的自然流产率和低出生体重儿的发生率;
- 将某些癌症的风险降低到一般人群的水平,包括小肠腺癌、食道癌和非霍奇金淋巴瘤;
- 减少有症状个体的额外死亡风险。
监测
对于乳糜泻患者,血清学检测应持续进行直至异常指标恢复正常,这通常发生在开始严格无麸质饮食后的6-12个月。
应考虑进行活检以确认小肠绒毛的恢复情况。因为部分严格遵守无麸质饮食患者的小肠恢复是逐渐发生的,所以通常应在初诊后至少两年进行活检。
对于分子遗传学检测发现具有HLA-DQ2或HLA-DQ8乳糜泻易感性单倍型但抗体结果阴性的无症状亲属,应每隔3-5年进行tTG IgA筛查来及时发现乳糜泻相关抗体的出现 [Hill et al 2005, NIH共识委员会 2005, Pietzak 2005]。
风险亲属的评估
乳糜泻患者一级亲属进行分子遗传学检测可以识别出乳糜泻易感亲属并利用血清学检测筛查出乳糜泻患者或无症状乳糜泻患者。值得注意的是,一级亲戚接受分子遗传学检测不需要以症状为依据。(请参阅检测策略,接受无麸质饮食仍有症状个体,分子遗传学检测。)
及早诊断乳糜泻并采用无麸质饮食治疗可以预防继发并发症的出现。
- 没有乳糜泻相关HLA等位基因DQ2和DQ8的个体无需进行乳糜泻血清学检测。
- 携带乳糜泻相关HLA等位基因者 (表3) 应每隔3-5年进行一次乳糜泻相关抗体检测。
- 当乳糜泻相关抗体检测呈阳性时,建议进行小肠活检。
- 小肠活检阳性且临床症状和/或组织学表现在接受无麸质饮食后改善的患者可确诊为乳糜泻。
遗传咨询
遗传咨询通过向患者及其家人提供遗传病的自然史、遗传特点及其影响等信息,来帮助他们在医疗和个人选择上做出有依据决定。下述内章节主要关注遗传风险评估、家族史和遗传检测方法的采集和使用,进而阐明家庭成员的遗传风险。本章内容无法尽数阐明患者可能面对的个人、文化、伦理问题,也无法替代与遗传病专家进行的咨询。—ED。
遗传模式
HLA-DQ2基因型相关的乳糜泻易感性遵从常染色体显性或常染色体隐性遗传模式,这取决于其父母的乳糜泻易感性HLA基因型 (参见图5A)。

图5.
遗传模式 A. DQ2相关乳糜泻易感性和 B. DQ8相关乳糜泻易感性,家系中父母之一携带对应的乳糜泻易感性HLA单倍型且另一方不携带 (查看更多信息请点击这里...)
家庭成员风险
对于HLA状况未知且具有一级亲属患病家族史的个体,发生乳糜泻的风险为5%-20% [Freeman 2010, Fasano et al 2003]。
先证者的父母
- 当已知父母具有DQ2异二聚体和/或DQ8异二聚体时,其患乳糜泻的风险增加。当仅具有DQ2异二聚体的一半(即具有HLA-DQA1序列变异或HLA-DQB1序列变异但不同时存在)时,风险较小。
- 尽管几乎所有诊断为具有DQ2或DQ8相关乳糜泻易感性者的父母都有DQ2或DQ8异二聚体或DQ2异二聚体的一半(即DQA1序列变异或DQB1序列变异),但常常由于外显率降低、家庭成员未诊断、受累父母疾病发病较晚或已死亡等因素使得家族史呈现为阴性。
先证者的同胞
- 如果HLA单倍型未知, 先证者同胞发生乳糜泻的总体经验风险为7%-20% [Treem 2004, Bardella et al 2007, Freeman 2010]。如果已知父母的HLA单倍型,其同胞的风险可被重新推算。
- 与先证者具有相同乳糜泻易感性HLA单倍型的同胞发生乳糜泻的风险为40% [Treem 2004]。
- 顺式(请参见图5A)图5B)50%。
- 如果 先证者的父母之一具有DQ2异二聚体的一半(HLA-DQA1 * 0501或* 0505),而另一方具有DQ2异二聚体的另一半(HLA-DQB1 * 0201或* 0202),则同胞风险如下:
获得两种HLA单倍型并以反式构型形成完整DQ2异二聚体的风险:25%
获得一半DQ2异二聚体(HLA-DQA1 * 0501或* 0505)或(HLA-DQB1 * 0201或* 0202)的风险:50%
两种乳糜泻易感性单倍型均未获得的几率:25%
先证者的子女
- 如果乳糜泻易感性HLA结果未知,先证者后代发生乳糜泻的总风险为5%-10%。当后代具有DQ2乳糜泻易感性HLA单倍型和/或DQ8乳糜泻易感性HLA单倍型时,其风险增加 [Treem 2004]。当仅存在一半的DQ2异二聚体(即仅存在DQA1序列变异或DQB1序列变异)时,风险较低。
- 具有DQ2乳糜泻易感性HLA单倍型(参见图5A)或DQ8乳糜泻易感性HLA单倍型(参见图5B)者的每个孩子都有50%的机会遗传乳糜泻易感性HLA单倍型。与父母具有相同HLA单倍型的孩子比具有相同HLA单倍型的先证者同胞的风险要低(即<40%)[Treem 2004]。
先证者的其他家庭成员
相关遗传咨询问题
有关高危亲属评估以期早期诊断、治疗的相关信息,请参阅治疗、风险亲属评估。
计划生育
DNA保藏是将DNA(通常从白细胞中提取)储存以备将来使用。因为我们的检测手段以及对基因、变异和疾病的认识很可能在未来被改变,所以需要考虑为受累个体进行DNA储存。.
产前检测
尽管在技术上可行,但乳糜泻易感性HLA变异的产前检测在这种复杂疾病中并不适用,原因如下:
- 遗传改变在普通人群中很普遍;
- 遗传改变仅影响乳糜泻的易感性,但不能预测发病;
- 存在高效的治疗方法。
相关资源
为了该疾病患者及其家人的利益,GeneReviews工作人员筛选发布了以下疾病专业组织、关爱组织和注册中心。GeneReviews不对其他组织提供的信息负责。关于选择标准的相关信息请点击。
- 乳糜泻基金会 (CDF)13251 Ventura Boulevard#1Studio City CA 91604Phone: 818-990-2354Fax: 818-990-2379Email: cdf@celiac.org
- 乳糜泻协会 (CSA)PO Box 31700Omaha NE 68131-0700Phone: 877-272-4272 (toll-free); 402-558-0600Email: celiacs@csaceliacs.org
- Medline Plus
- My46 Trait Profile
- National Foundation for Celiac Awareness (NFCA)PO Box 544Ambler PA 19002-0544Phone: 215-325-1306Email: info@celiacawareness.org
- 北美麸质不耐受集团31214 124th Avenue SoutheastAuburn WA 98092Phone: 253-833-6655Fax: 253-833-6675Email: info@gluten.net; admin@gluten.net
分子遗传学
分子遗传学及OMIM表格信息可能与GeneReview中的其他章节存在出入: 表格中可能包含更新的信息。 - ED.
表 A. 乳糜泻:基因和数据库
表 B. OMIM词目乳糜泻 (在OMIM中查看全部信息)
分子遗传学发病机制
乳糜泻是一种由针对麦醇溶蛋白(麸质的一种成分)的免疫反应引起在遗传易感个体发生的多因素疾病,主要表现为小肠发炎、绒毛损害和吸收不良。与乳糜泻易感性相关的HLA-DQA1和HLA-DQB1等位基因变异是必要条件,但不足以引起疾病。 许多肠外表现的病因尚未完全阐明。 其他基因(多与免疫系统或肠道通透性有关)和环境因素也参与其中。
单击这里(pdf)了解更多与乳糜泻相关其他基因位点的信息。
乳糜泻的免疫学机制。
消化系统中的炎症机制和免疫反应在正常工作时可防御来自食物和饮水中的细菌、毒素和其他外来成分。IgA抗体由肠道免疫系统大量产生并在粘膜局部免疫中发挥重要作用。然而在发生乳糜泻时,不适当的免疫反应会引起慢性炎症和肠粘膜损害,其涉及免疫应答的两个主要类别:适应性免疫应答(HLA特异性)和先天性免疫应答(不依赖HLA)。
适应性免疫应答(HLA特异性):DQ2和DQ8的作用
组织转谷氨酰胺酶(tTG)是一种在人体各组织广泛存在的酶,发挥促进伤口愈合、骨骼生长的作用。在肠道中,tTG会使麦醇溶蛋白脱氨基,导致麸质肽带上负电荷。粘膜固有层中的抗原呈递细胞(APC)表面蛋白DQ2和DQ8优先结合这些带负电荷的脱酰胺麸质肽(参见图6和图7)。麸质反应性T辅助细胞(表面标记CD4阳性)在识别与APC上DQ2或DQ8结合的脱酰胺麸质肽后被激活,并产生包括干扰素γ(IFN-γ)在内的细胞因子。随后的炎症反应释放额外的细胞因子和化学物质,导致绒毛损伤并萎缩。伴随炎症发生,发炎肠道组织中的浆细胞释放抗体,包括抗麦醇溶蛋白和抗肌内膜肌抗体,以及针对tTG的自身免疫抗体 (参见图7) [Treem 2004, Alaedini & Green 2005, Sollid & Lie 2005]。
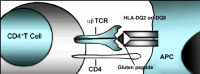
图6.
麸质反应性CD4+ T辅助细胞 (携带细胞表面CD4标记) 在其TCR识别粘膜固有层APC表面HLA-DQ2或HLA-DQ8蛋白分子呈递的麸质肽之后被激活。(查看更多信息请点击这里...)
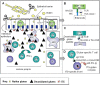
图7.
乳糜泻患者小肠病变中同时存在适应性免疫和先天性免疫机制。A.麸质肽通过上皮屏障并被组织转谷氨酰胺酶(tTG)脱酰胺。固有层中的CD4+ T细胞识别 (查看更多信息请点击这里...)
乳糜泻与HLA-DQA1和HLA-DQB1位点等位基因编码的II类HLA蛋白分子DQ2和DQ8密切相关。这些HLA-DQ序列变异是影响乳糜泻易感性的最重要遗传因素,其余因素为非HLA基因中的未知变异。绝大多数(> 90%)乳糜泻患者为DQ2阳性,其余大多数为DQ8阳性。一小部分为DQ2半分子。DQ2和DQ8将麸质中的麦醇溶蛋白组分提呈给肠道粘膜免疫系统中的特定CD4+ T辅助细胞,从而赋予乳糜泻易感性 (参见图6和图7) [Sollid 2002, Sollid & Lie 2005]。
影响DQ2和DQ8蛋白分子的等位基因变异
HLA-DQ2和-DQ8蛋白在位于抗原呈递细胞(APC)表面形成异二聚体。DQ2和DQ8蛋白分别由HLA-DQA1和HLA-DQB1基因特定序列编码的α链和β链组成。
具有DQ2的乳糜泻患者:
- 具有DR17-DQ2乳糜泻易感性单倍型 [HLA-DRB1*0301;HLA-DQA1*0501;HLA-DQB1*0201]
或者 - 乳糜泻易感性单倍型DR11或DR12-DQ7 [HLA-DRB1*11/12;HLA-DQA1*0505;DQB1*0301]或DR7-DQ2 [HLA-DRB1*07;HLA-DQA1*0201;HLA-DQB1*0202] 的杂合子
具有DQ8的乳糜泻患者具有DR4-DQ8乳糜泻易感性单倍型 (HLA-DRB1*04; HLA-DQA1*03;HLA-DQB1*0302) [Sollid & Lie 2005] (参见图1)。
固有免疫应答。
除了图6所描述的涉及CD4+ T辅助细胞的适应性免疫机制外,涉及上皮内CD8+细胞毒性T淋巴细胞(IEL)的先天性免疫应答在乳糜泻的发病中也发挥作用。在乳糜泻患者中,麸质通过引发IEL产生过量的白介素15细胞因子(IL-15)独立地诱导上皮应激。应激分子MIC和HLA-E也被诱导产生,其上调表达CD8+ T细胞表面的激活性NK受体(例如NKG2D),从而赋予T细胞类似NK的特性,然后不加选择地攻击肠道上皮细胞、引发肠道损伤 [Hüe et al 2004, Jabri et al 2005] (参见图7)。
参考文献
引用文献
- Alaedini A, Green PH. Narrative review: celiac disease: understanding a complex autoimmune disorder. Ann Intern Med. 2005;142:289 - 98. [PubMed: 15710962]
- Bardella MT, Elli L, Velio P, Fredella C, Prampolini L, Cesana B. Silent celiac disease is frequent in the siblings of newly diagnosed celiac patients. Digestion. 2007;75:182 - 7. [PubMed: 17848794]
- Catassi C, Fasano A. Celiac disease diagnosis: Simpler rules are better than complicated algorithms. Am J Med. 2010;123:691 - 3. [PubMed: 20670718]
- Catassi C, Lionetti E, Sapone A. Gluten sensitivity. In: Fassano A, ed. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia. PA: Lippincot Williams & Wilkins; 2014.
- Collin P, Kekkonen L, Virta L, Reunala T, Kaukinen K. The diagnostic criteria of coeliac disease. Acta Paediatr. 2007;96:604. [PubMed: 17306007]
- D'Amico MA, Holmes J, Stavropoulos SN, Frederick M, Levy J, DeFelice AR, Kazlow PG, Green PH. Presentation of pediatric celiac disease in the United States: prominent effect of breastfeeding. Clin Pediatr (Phila) 2005;44:249 - 58. [PubMed: 15821850]
- Fasano A. Zonulin and its regulation of intestinal barrier function: The biological door to inflammation, autoimmunity, and cancer. Physiol Rev. 2011;91:151 - 75. [PubMed: 21248165]
- Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, Elitsur Y, Green PH, Guandalini S, Hill ID, Pietzak M, Ventura A, Thorpe M, Kryszak D, Fornaroli F, Wasserman SS, Murray JA, Horvath K. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States. Arch Intern Med. 2003;163:286 - 92. [PubMed: 12578508]
- Fasano A, Catassi C. Coeliac disease in children. Best Pract Res Clin Gastroenterol. 2005;19:467 - 78. [PubMed: 15925850]
- Freeman HJ. Risk factors in familial forms of celiac disease. World J Gastroenterol. 2010;16:1828 - 31. [PMC free article: PMC2856821] [PubMed: 20397258]
- Green PH. The many faces of celiac disease: clinical presentation of celiac disease in the adult population. Gastroenterology. 2005;128:S74 - 8. [PubMed: 15825130]
- Green PH, Cellier C. Celiac disease. N Engl J Med. 2007;357:1731 - 43. [PubMed: 17960014]
- Green PH, Jabri B. Coeliac disease. Lancet. 2003;362:383 - 91. [PubMed: 12907013]
- Guandalini S. Celiac disease. In: Guandalini S, ed. Textbook of Pediatric Gastroenterology and Nutrition. London, UK: Taylor & Francis Books, Ltd; 2004:435-50.
- Guandalini S, Assiri A. Celiac disease: a review. JAMA Pediatr. 2014;168:272 - 8. [PubMed: 24395055]
- Guandalini S, Discepolo V, Newland C, Kupfer S. Celiac disease. In: Fassano A, ed. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia, PA: Lippincott Williams & Wilkins; 2014.
- Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, Hoffenberg EJ, Horvath K, Murray JA, Pivor M, Seidman EG., North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005;40:1 - 19. [PubMed: 15625418]
- Hill I, Rakitt T. Diagnosis. In: Fassano A, ed. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia, PA: Lippincott Williams & Wilkins; 2014.
- Hoffenberg E, Flass T, Friedlander J, Liu E, Kramer R. Difficult cases. In: Fassano A, ed. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia, PA: Lippincott Williams & Wilkins; 2014.
- Hoffenberg EJ, MacKenzie T, Barriga KJ, Eisenbarth GS, Bao F, Haas JE, Erlich H, Bugawan TL, Sokol RJ, Taki I, Norris JM, Rewers M. A prospective study of the incidence of childhood celiac disease. J Pediatr. 2003;143:308 - 14. [PubMed: 14517510]
- Hüe S, Mention JJ, Monteiro RC, Zhang S, Cellier C, Schmitz J, Verkarre V, Fodil N, Bahram S, Cerf-Bensussan N, Caillat-Zucman S. A direct role for NKG2D/MICA interaction in villous atrophy during celiac disease. Immunity. 2004;21:367 - 77. [PubMed: 15357948]
- Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Maki M, Ribes-Koninckx C, Ventura A, Zimmer KP., ESPGHAN Working Group on Coeliac Disease Diagnosis. on behalf of the ESPGHAN Gastroenterology Committee. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr. 2012;54:136 - 60. [PubMed: 22197856]
- Ivarsson A, Hernell O, Stenlund H, Persson LA. Breast-feeding protects against celiac disease. Am J Clin Nutr. 2002;75:914 - 21. [PubMed: 11976167]
- Jabri B, Kasarda DD, Green PH. Innate and adaptive immunity: the yin and yang of celiac disease. Immunol Rev. 2005;206:219 - 31. [PubMed: 16048552]
- Karinen H, Karkkalnen P, Pihlajamaki J, Janatuinen E, Heikkinen M, Julkunen R, Kosma V, Naukkarinen A, Laakso M. Gene dose effect of the DQB1*0201 allele contributes to severity of celiac disease. Scand J Gastroenterol. 2006;41:191 - 9. [PubMed: 16484124]
- Lasa JS, Zubiaurre I, Soifer LO. Risk of infertility in patients with celiac disease: a meta-analysis of observational studies. Arq Gastroenterol. 2014;51:144 - 50. [PubMed: 25003268]
- Lebwohl B, Kapel RC, Neugut AI, Green PHR, Genta RM. Adherence to biopsy guidelines increases celiac disease diagnsosis. Gastrointestinal Endoscopy. 2011;74:103 - 9. [PMC free article: PMC3651876] [PubMed: 21601201]
- Lebwohl B, Rubio-Tapia A, Assiri A, Newland C, Guandalini S. Diagnosis of celiac disease. Gastrointest Endosc Clin N Am. 2012;22:661 - 77. [PMC free article: PMC4005880] [PubMed: 23083985]
- Leffler DA, Schuppan D. Update on serologic testing in celiac disease. Am J Gastroenterol. 2010;105:2520 - 4. [PubMed: 21131921]
- Levy J, Levy-Carrick N. Wheat allergy. In: Fassano A, ed. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia, PA: Lippincott Williams & Wilkins; 2014.
- Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, Barbato M, Barbera C, Barera G, Bellantoni A, Castellano E, Guariso G, Limongelli MG, Pellegrino S, Polloni C, Ughi C, Zuin G, Fasano A, Catassi C. SIGENP (Italian Society of Pediatric Gastroenterology, Hepatology, and Nutrition) Working Group on Weaning and CD Risk. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med. 2014;371:1295 - 303. [PubMed: 25271602]
- Liu E, Li M, Emery L, Taki I, Barriga K, Tiberti C, Eisenbarth GS, Rewers MJ, Hoffenberg EJ. Natural history of antibodies to deamidated gliadin peptides and transglutaminase in early childhood celiac disease. J Pediatr Gastroenterol Nutr. 2007;45:293 - 300. [PubMed: 17873740]
- Lo W, Sano K, Lebwohl B, Diamond B, Green PH. Changing presentation of adult celiac disease. Dig Dis Sci. 2003;48:395 - 8. [PubMed: 12643621]
- Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C. The Oslo definitions for coeliac disease and related terms. Gut. 2013;62:43 - 52. [PMC free article: PMC3440559] [PubMed: 22345659]
- Margaritte-Jeannin P, Babron MC, Bourgey M, Louka AS, Clot F, Percopo S, Coto I, Hugot JP, Ascher H, Sollid LM, Greco L, Clerget-Darpoux F. HLA-DQ relative risks for coeliac disease in European populations: a study of the European Genetics Cluster on Coeliac Disease. Tissue Antigens. 2004;63:562 - 7. [PubMed: 15140032]
- Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue'). Gastroenterology. 1992;102:330 - 54. [PubMed: 1727768]
- Megiorni F, Mora B, Bonamico M, Barbato M, Nenna R, Maiella G, Lulli P, Mazzilli MC. HLA-DQ and risk gradient for celiac disease. Hum Immunol. 2009;70:55 - 9. [PubMed: 19027045]
- Murray JA, Watson T, Clearman B, Mitros F. Effect of a gluten-free diet on gastrointestinal symptoms in celiac disease. Am J Clin Nutr. 2004;79:669 - 73. [PubMed: 15051613]
- NIH Consensus Committee. National Institutes of Health consensus development conference statement on celiac disease, June 28-30, 2004. Gastroenterology. 2005;128:S1 - 9. [PubMed: 15825115]
- Oxentenko AS, Murray JA. Celiac disease: Ten things that every gastroenterologist should know. Clin Gastroenterol Hepatol. 2015;13:1396 - 404. [PubMed: 25051511]
- Pietzak MM. Follow-up of patients with celiac disease: achieving compliance with treatment. Gastroenterology. 2005;128:S135 - 41. [PubMed: 15825121]
- Pietzak MM, Schofield TC, McGinnis FM, Nakamura RM. Stratifying risk for celiac disease in a large at-risk United States population by using HLA alleles. Clin Gastroenterol Hepatol. 2009;7:966 - 71. [PubMed: 19500688]
- Rampertab SD, Pooran N, Brar P, Singh P, Green PH. Trends in the presentation of celiac disease. Am J Med. 2006;119:355.e9 - 14. [PubMed: 16564784]
- Rubio-Tapia A, Ludvigsson JF, Brantner TL, Murray JA, Everhart JE. The prevalence of celiac disease in the United States. Am J Gastroenterol. 2012;107:1538 - 44. [PubMed: 22850429]
- Rubio-Tapia A, Hill ID, Kelly CP, Calderwood MD, Murray JA. ACG clinical guidelines Diagnosis and management of celiac disease. Am J Gastroenterol. 2013;108:656 - 76. [PMC free article: PMC3706994] [PubMed: 23609613]
- Sanders DS, Carter MJ, Hurlstone DP, Pearce A, Ward AM, McAlindon ME, Lobo AJ. Association of adult coeliac disease with irritable bowel syndrome: a case-control study in patients fulfilling ROME II criteria referred to secondary care. Lancet. 2001;358:1504 - 8. [PubMed: 11705563]
- Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PHR. Hadjivassiliuo, Kaukinen K, Rostam K, Sanders DS, Schumann M, Ullrich R, Villalta D, Volta U, Catassi C, Fasano A. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med. 2012;10:13. [PMC free article: PMC3292448] [PubMed: 22313950]
- Sapone A, Lammers KM, Casolaro V, Cammarota M, Giuliano MT, De Rosa M, Stefanile R, Mazzarella G, Tolone C, Russo MI, Esposito P, Ferraraccio F, Carteni M, Giegler G, de Magistris L, Fasano A. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: Celiac disease and gluten sensitivity. BMC Med. 2011;9:23. [PMC free article: PMC3065425] [PubMed: 21392369]
- Sollid LM. Coeliac disease: dissecting a complex inflammatory disorder. Nat Rev Immunol. 2002;2:647 - 55. [PubMed: 12209133]
- Sollid LM, Jabri B. Is celiac disease an autoimmune disorder? Curr Opin Immunol. 2005;17:595 - 600. [PubMed: 16214317]
- Sollid LM, Lie BA. Celiac disease genetics: current concepts and practical applications. Clin Gastroenterol Hepatol. 2005;3:843 - 51. [PubMed: 16234020]
- Stavropoulos SN, Green PHR, Panagi SG, Goldstein SL, McMahon D, Absan H, Neugut A. Characteristics of adult celiac disease in the USA: results of a national survey. Am J Gastroenterol. 2001;96:126 - 31. [PubMed: 11197241]
- Treem WR. Emerging concepts in celiac disease. Curr Opin Pediatr. 2004;16:552 - 9. [PubMed: 15367850]
- Vermeersch P, Geboes K, Mariën G, Hoffman I, Hiele M, Bossuyt X. Diagnostic performance of IgG anti-deamidated gliadin peptide antibody assays is comparable to IgA anti-tTG in celiac disease. Clin Chim Acta. 2010;411:931 - 5. [PubMed: 20171961]
- Vriezinga SL, Auricchio R, Bravi E, Castillejo G, Chmielewska A, Crespo Escobar P, Kolaček S, Koletzko S, Korponay-Szabo IR, Mummert E, Polanco I, Putter H, Ribes-Koninckx C, Shamir R, Szajewska H, Werkstetter K, Greco L, Gyimesi J, Hartman C, Hogen Esch C, Hopman E, Ivarsson A, Koltai T, Koning F, Martinez-Ojinaga E, te Marvelde C, Pavic A, Romanos J, Stoopman E, Villanacci V, Wijmenga C, Troncone R, Mearin ML. Randomized feeding intervention in infants at high risk for celiac disease. N Engl J Med. 2014;371:1304 - 15. [PubMed: 25271603]
- Yang A, Chen Y, Scherl E, Neugut AI, Bhagat G, Green PH. Inflammatory bowel disease in patients with celiac disease. Inflamm Bowel Dis. 2005;11:528 - 32. [PubMed: 15905699]
- Zubillaga P, Vidales MC, Zubillaga I, Ormaechea V, García-Urkía N, Vitoria JC. HLA-DQA1 and HLA-DQB1 genetic markers and clinical presentation in celiac disease. J Pediatr Gastroenterol Nutr. 2002;34:548 - 54. [PubMed: 12050583]
推荐阅读
- Fasano A. Clinical Guide to Gluten-Related Disorders. NASPGHAN Foundation. Philadelphia, PA: Lippincott Williams &Wilkins; 2014.
- Green PH, Jones R. Celiac Disease: A Hidden Epidemic. HarperCollins Publishers; 2006.
本章注释
鸣谢
我们要感谢遗传咨询师Katie Storm女士,感谢她对修订所做的贡献。
我们还要感谢Ludvig Sollid博士,感谢他与我们分享他的知识和观点。
作者信息
Peter HR Green, MD (2008-present)
Benjamin Lebwohl, MD, MS (2015-present)
Cara L Snyder, MS, CGC (2008-present)
Annette K Taylor, MS, PhD, CGC (2008-present)
Danielle O Young, MS, CGC; Kimball Genetics, Inc (2008-2015)
修订历史
- 2015年9月17日(me) 全面更新发布
- 2008年7月 3日(me) 修订发布
- 2006年9月28日(cs) 首次上传